题目内容
接触法制硫酸排放的尾气中,含少量的二氧化硫。某硫酸厂为了防止环境污染,并设法对尾气进行综合利用,采用氨水吸收尾气中的二氧化硫,再向吸收液中加入浓硫酸,以制取高浓度的SO2、(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中有关反应的离子方程式为:________________________________。
(2)由Ⅰ组数据直接推测:标准状况下用3.7 g样品进行同样实验时,生成氨气的体积为________L。
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比________。
(4)欲计算该NaOH溶液的物质的量浓度,应选择第________组数据,由此求得NaOH溶液的物质的量浓度为________。
解析:(NH4)2SO4、NH4HSO4与NaOH溶液共热,先发生反应H++OH-====H2O,再发生反应![]() 。由Ⅰ、Ⅱ数据知,7.4 g或14.8 g样品跟NaOH溶液完全反应,NaOH过量。
。由Ⅰ、Ⅱ数据知,7.4 g或14.8 g样品跟NaOH溶液完全反应,NaOH过量。
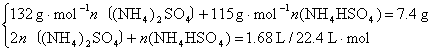
从而可求得
n〔(NH4)2SO4〕=0.0125 mol
n〔NH4HSO4〕=0.050 mol
即n〔(NH4)2SO4〕∶n(NH4HSO4)=1∶4。
由Ⅲ组中的数据可求得c(NaOH)。
n(NaOH)=n(NH4HSO4)+n(NH3)
=![]() ×0.05 mol+
×0.05 mol+![]() =0.20 mol
=0.20 mol
c(NaOH)=![]() =5.00 mol·L-1。
=5.00 mol·L-1。
![]()

练习册系列答案
相关题目