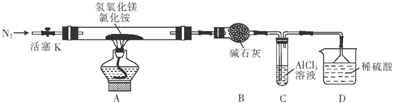
题目内容
2.NA代表阿伏伽德罗常数.下列说法正确的是( )| A. | 含NA个H的H2的物质的量为1 mol | |
| B. | NA个CO和1 mol N2所含分子数相等 | |
| C. | NA个H2SO4与1mol H3PO4所含氢原子的个数比为1:1 | |
| D. | 0.1mol C含1.2NA个质子 |
分析 A.含NA个H的H2的物质的量为0.5mol;
B.NA个CO的物质的量为1mol,1mol一氧化碳和1mol氮气中含有的分子数一定相等;
C.NA个H2SO4的物质的量为1mol,含有2mol氢原子,而1mol磷酸中含有3mol氢原子;
D.碳原子含有6个质子,0.1mol碳原子中含有0.6mol质子.
解答 解:A.1mol氢气分子中含有2mol氢原子,则含NA个H的H2的物质的量为0.5mol,故A错误;
B.NA个CO的物质的量为1mol,和1 mol N2所含分子数相等,故B正确;
C.NA个H2SO4的物质的量为1mol,含有2mol氢原子,而1mol H3PO4中含有3mol氢原子,二者含有的氢原子的个数比为2:3,故C错误;
D.0.1mol C含0.6mol质子,含有0.6NA个质子,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确分子、原子、原子核内质子中子及核外电子的构成关系,熟练掌握物质的量与摩尔质量等物理量之间的关系.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
13.一定条件下,下列物质不能与Al3+发生反应的是( )
| A. | 盐酸 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 水 |
10.某校化学兴趣小组在实验中发现一瓶溶液.标签上标有“CaCl2 0.1mol•L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )
| A. | 配制1L该溶液,可将0.1mol CaCl2溶于1L水中 | |
| B. | Ca2+和Cl-的物质的量浓度都是0.1mol•L-1 | |
| C. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05mol•L-1 | |
| D. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1mol•L-1 |
17.能正确表示下列反应的离子方程式是( )
| A. | 等体积、等浓度的Ca(HCO3)2 溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O | |
| B. | NH4HCO3 溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液转:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2 +2H2O═Al(OH)3 ↓+HCO3- |
7.密度为1.17g•cm-3、浓度为36.5%的浓盐酸中,HCl的物质的量浓度为( )
| A. | 13.2mol•L-1 | B. | 5.85mol•L-1 | C. | 23.4mol•L-1 | D. | 11.7mol•L-1 |
5.氯化亚铜(CuCI)是有机合成工业中应用较广泛的催化剂,微溶于水,不溶于乙醇.工业上以废旧铜为原料生产氯化亚铜的流程如下:
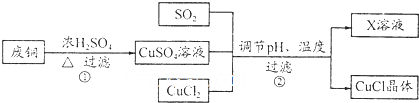
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
(3)析出的CuCl晶体不用水而用乙醇洗涤的目的是CuCl不溶于乙醇,微溶于水,可减少晶体损失,且乙醇易挥发,利于干燥.
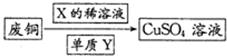
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).

(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).

方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
3.下列实验操作或装置正确的是( )
| A. | 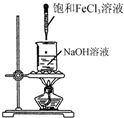 制备氢氧化铁胶体 | B. | 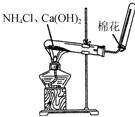 制取NH3 | ||
| C. | 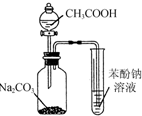 证明H2CO3酸性强于苯酚 | D. | 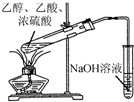 制备乙酸乙酯 |