题目内容
(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用 的混合溶液可溶出印刷电路板金属粉末中的铜。
的混合溶液可溶出印刷电路板金属粉末中的铜。 已知:
已知:
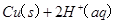 ====
====
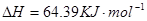
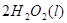 ====
====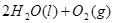

 ====
====


在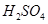 溶液中
溶液中 与
与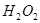 反应生成
反应生成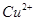 和
和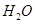 的热化学方程式为
的热化学方程式为
。
(3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式 。
(8分)(1)BD
(2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68KJ.mol-1
(3)
4Al(s)+ 3CO2(g) 3C(s)+ 2Al2O3(s),
3C(s)+ 2Al2O3(s),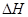 = (3
= (3 a-4b)KJ/mol
a-4b)KJ/mol
【解析】(1)考查化学与生活、生产及环境保护等。BD容易造成环境污染,是不正确的,答案选BD。
(2)考查盖斯定律的应用。根据反应①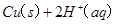 ====
====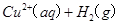 、反应②
、反应②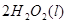 ====
====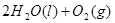 和反应③
和反应③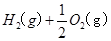 ====
==== 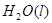 可知,①+②÷2+3即得到Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l),所以反应热是64.39 KJ/mol-196.46 KJ/mol÷2-285.84 KJ/mol=—319.68KJ.mol-1。
可知,①+②÷2+3即得到Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l),所以反应热是64.39 KJ/mol-196.46 KJ/mol÷2-285.84 KJ/mol=—319.68KJ.mol-1。
(3)根据①C(s)+O2(g)=CO2(g)
△H= —aKJ.mol-1、②4Al(s)+3O2(g)=2Al2O3(g)
△H= —4bKJ.mol-1可知,②-①×3即得到4Al(s)+ 3CO2(g) 3C(s)+ 2Al2O3(s),
3C(s)+ 2Al2O3(s),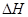 = (3
= (3 a-4b)KJ/mol
a-4b)KJ/mol

(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_______(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+ (aq)====Cu2+ (aq)+H2(g) ΔH=64.39 kJ·mol-1
2H2O2(l)====2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
![]() ====H2O(l) ΔH=-285.84 kJ·mol-1
====H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_____________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率/×10-3 mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是_________________________________________________________。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油B.露天焚烧 C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)
△H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
(5) 已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ; H
H
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
(6)已知1 g FeS2(s)完全燃烧生成放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。