题目内容
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应: 2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)= ![]() molL﹣1s﹣1
molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2mol SO2、1mol O2 , 反应达到新平衡时 ![]() 增大
增大
【答案】D
【解析】解:A、三氧化硫表示的反应速率v= ![]() =
= ![]() =
= ![]() molL﹣1s﹣1,化学反应速率之比等于系数之比,氧气的平均速率为
molL﹣1s﹣1,化学反应速率之比等于系数之比,氧气的平均速率为 ![]() ×
× ![]() molL﹣1s﹣1,故A错误;
molL﹣1s﹣1,故A错误;
B、保持其他条件不变,体积压缩到1.0L,平衡常数不变,故B错误;
C、相同温度下,起始时向容器中充入4mol SO3,根据极限转化的思想,向容器中充入4mol SO3,相当于投入4mol二氧化硫和2mol氧气,增加二氧化硫的量,会降低其转化率,故C错误;
D、温度不变,向该容器中再充入2mol SO2、1mol O2,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减小,所以比值增大,故D正确.
故选D.
A、根据公式v= ![]() 计算三氧化硫表示的反应速率,根据化学反应速率之比等于系数之比计算氧气的平均速率;
计算三氧化硫表示的反应速率,根据化学反应速率之比等于系数之比计算氧气的平均速率;
B、平衡常数只受温度的影响;
C、根据极限转化的思想,向容器中充入4mol SO3,相当于投入4mol二氧化硫和2mol氧气;
D、根据压强对化学反应速率的影响知识来回答判断.

【题目】化学反应中存在两大变化,即__变化和__变化。由于断开不同的化学键__的能量不同,形成不同的化学键__的能量也不同,所以化学反应中总会伴有__的变化,最终的反应结果表现为___能量和__能量。
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=-akJ/mol
2CO2(g) ΔH=-akJ/mol
②N2(g)+O2(g)![]() 2NO(g) ΔH=+bkJ/mol
2NO(g) ΔH=+bkJ/mol
③2NO(g)+O2(g)![]() 2NO2(g) ΔH=-ckJ/mol
2NO2(g) ΔH=-ckJ/mol
回答下列问题:
(1)CO的燃烧热为_________。
(2)CO将NO2还原为单质的热化学方程式为_________。
(3)为了模拟反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=_________,此温度下,该反应的平衡常数K=_________。
②能说明上述反应达到平衡状态的是________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。
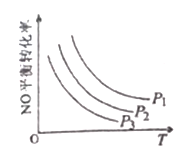
则NO的平衡转化率随温度升高而减小的原因是______________,图中压强(P1、P

