题目内容
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
(每空2分,共14分)
(1) 1s22s22p63s23p6
(2) Na>Al>S>O
(3)N>O>Al>Na
(4)Na+[: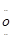 :
: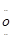 :]2-Na+
:]2-Na+
(5) 第三周期,ⅢA族, Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
(6) ΔH=(2a+b+2c)kJ/mol
(1) 1s22s22p63s23p6
(2) Na>Al>S>O
(3)N>O>Al>Na
(4)Na+[:
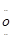 :
: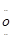 :]2-Na+
:]2-Na+(5) 第三周期,ⅢA族, Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
(6) ΔH=(2a+b+2c)kJ/mol
试题分析:由A的电子层结构,可以推知为2s22p3,为N,又B和E为同一主族,C、D、E为同周期,B为O或F,C、D、E为第三周期,外层有一个未成对电子的可能为Na和Al,从而确定B为O、E为S。
(1)要注意为S的离子
(2)原子半径先比较电子层,电子层越多半径越大,再比较核电荷数,越多半径越小
(3)第一电离能整体上同周期从左到右为增大趋势,同主族从上到下,减小;这里N为半充满,反常。
(4)Na2O2的电子式
(5)Al的位置以及制备Al(OH)3,要考虑氢氧化铝的两性,既能溶于酸又能溶于碱,故不能用强碱,用氨水。
(6)由盖斯定律有目标反应等于①×2+②+③×2

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。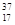 Cl、
Cl、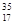 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是