题目内容
甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物.已知甲、乙、丙均不含结晶水,含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液;化合物乙是光导纤维的主要成分;化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水.生成的Y折合成标准状况下的体积为4.48L.固体X难溶于水,能溶于硫酸,形成蓝色溶液.请回答下列问题:
(1)写出气体Y的结构式______,化合物丙的化学式______.
(2)写出甲与NaOH溶液反应的离子方程式______.另外,工业上常用甲与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,请写出该反应的化学方程式并标出电子转移的方向和数目______.
(3)乙溶于氢氟酸后生成一种极强的二元酸和水.经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%.请写出乙溶于氢氟酸的离子反应方程式______.
(4)将固体X溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,若再滴加数滴乙二醇,可观察到溶液呈绛蓝色.可见,该蓝色絮状沉淀物具有______.
A.酸性 B.碱性 C.两性 D.强还原性
请写出与乙二醇反应的化学方程式(无机反应物用蓝色絮状沉淀物的化学式表示)______.
(1)写出气体Y的结构式______,化合物丙的化学式______.
(2)写出甲与NaOH溶液反应的离子方程式______.另外,工业上常用甲与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,请写出该反应的化学方程式并标出电子转移的方向和数目______.
(3)乙溶于氢氟酸后生成一种极强的二元酸和水.经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%.请写出乙溶于氢氟酸的离子反应方程式______.
(4)将固体X溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,若再滴加数滴乙二醇,可观察到溶液呈绛蓝色.可见,该蓝色絮状沉淀物具有______.
A.酸性 B.碱性 C.两性 D.强还原性
请写出与乙二醇反应的化学方程式(无机反应物用蓝色絮状沉淀物的化学式表示)______.
甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物.
含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al2O3;
化合物乙是光导纤维的主要成分,乙为SiO2;
化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,结合物质含有的元素,故Y为CO2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO2折合成标准状况下的体积为4.48L,物质的量为
=0.2mol,根据碳元素守恒可知CuCO3为0.2mol,24gCuO的物质的量为
=0.3mol,根据铜元素守恒Cu(OH)2为0.3mol-0.2mol=0.1mol,故碱式碳酸铜中n(CuCO3):n[Cu(OH)2]=0.2mol:0.1mol=2:1,故该碱式碳酸铜化学式为2CuCO3?Cu(OH)2,
(1)由上述分析可知,Y为CO2,分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,化合物丙为2CuCO3?Cu(OH)2;
故答案为:O=C=O,2CuCO3?Cu(OH)2;
(2)甲为Al2O3,Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
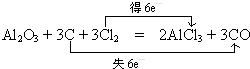
工业上常用Al2O3与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,由元素守恒可知丁为AlCl3,反应方程式为Al2O3+3C+3Cl2
3CO+2AlCl3,C元素化合价由0价升高为+2,失去电子数为6,氯元素化合价由0价降低为-1价,获得电子数目为6,标出电子转移的方向和数目为:
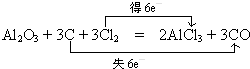
;
故答案为:Al2O3+2OH-=2AlO2-+H2O;

;
(3)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有
=79.17%,联立解得x=1,y=6,故该酸为H2SiF6,故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62-+2H2O;
故答案为:SiO2+6HF=2H++SiF62-+2H2O;
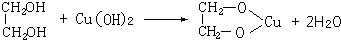
(4)将固体CuO溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,为Cu(OH)2,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,说明Cu(OH)2具有两性,再滴加数滴乙二醇,可观察到溶液呈绛蓝色,羟基处于邻位的多元醇或多羟基化合物,能与氢氧化铜发生络合反应变成绛蓝色溶液,反应方程式为:
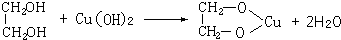
;
故答案为:C,

.
含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al2O3;
化合物乙是光导纤维的主要成分,乙为SiO2;
化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,结合物质含有的元素,故Y为CO2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO2折合成标准状况下的体积为4.48L,物质的量为
| 4.48L |
| 22.4L/mol |
| 24g |
| 80g/mol |
(1)由上述分析可知,Y为CO2,分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,化合物丙为2CuCO3?Cu(OH)2;
故答案为:O=C=O,2CuCO3?Cu(OH)2;
(2)甲为Al2O3,Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
工业上常用Al2O3与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,由元素守恒可知丁为AlCl3,反应方程式为Al2O3+3C+3Cl2
| ||

;
故答案为:Al2O3+2OH-=2AlO2-+H2O;

;
(3)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有
| 19y |
| 2+28x+19y |
故答案为:SiO2+6HF=2H++SiF62-+2H2O;
(4)将固体CuO溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,为Cu(OH)2,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,说明Cu(OH)2具有两性,再滴加数滴乙二醇,可观察到溶液呈绛蓝色,羟基处于邻位的多元醇或多羟基化合物,能与氢氧化铜发生络合反应变成绛蓝色溶液,反应方程式为:

;
故答案为:C,

.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目