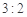题目内容
某研究小组探究:
I .铜片和浓硫酸的反应(夹持装置和A中加热装置已略,气密性已检验)
II. SO2和 Fe( NO3)3溶液的反应[1.0 mol/L的 Fe(NO3)3溶液的 pH=1]请回答下列有关问题:
探究I
(l)某学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。
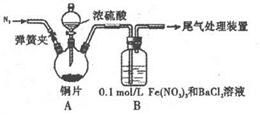
①装置A中反应的化学方程式是_______
②该同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______。
(3)裝置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1:SO2与Fe3+反应;猜想2 :在酸性条件下SO2与NO3-反应;猜想3:____________;
①按猜想1,装置B中反应的离子方程式是______,证明该猜想应进一步确认生成的新物质,其实验操作及现象是____________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
a.0.1 mol/L 稀硝酸 b. 1.5 mol/L Fe(NO3)2溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
I .铜片和浓硫酸的反应(夹持装置和A中加热装置已略,气密性已检验)
II. SO2和 Fe( NO3)3溶液的反应[1.0 mol/L的 Fe(NO3)3溶液的 pH=1]请回答下列有关问题:
探究I
(l)某学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。

①装置A中反应的化学方程式是_______
②该同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______。
(3)裝置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1:SO2与Fe3+反应;猜想2 :在酸性条件下SO2与NO3-反应;猜想3:____________;
①按猜想1,装置B中反应的离子方程式是______,证明该猜想应进一步确认生成的新物质,其实验操作及现象是____________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
a.0.1 mol/L 稀硝酸 b. 1.5 mol/L Fe(NO3)2溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
(13分)(1)①2H2SO4(浓)+Cu CuSO4+2H2O+2SO2↑(2分) ②AC(2分)
CuSO4+2H2O+2SO2↑(2分) ②AC(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)猜想3:SO2和Fe3+、酸性条件下NO3-都反应(1分)
①Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+(2分)(可分步写SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓(各1分);取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,猜想1合理(2分)②c(2分)
 CuSO4+2H2O+2SO2↑(2分) ②AC(2分)
CuSO4+2H2O+2SO2↑(2分) ②AC(2分)(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)猜想3:SO2和Fe3+、酸性条件下NO3-都反应(1分)
①Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+(2分)(可分步写SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓(各1分);取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,猜想1合理(2分)②c(2分)
试题分析:(1)①浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水,反应的化学方程式为2H2SO4(浓)+Cu
 CuSO4+2H2O+2SO2↑。
CuSO4+2H2O+2SO2↑。②A、由于生成的SO2气体中还含有水蒸气,而水蒸气也能被碱石灰吸收,所以不能通过称量碱石灰反应前后的质量计算SO2的质量,A不正确;
B、SO2具有还原性,能被酸性高锰酸钾溶液氧化生成硫酸,进而生成生成白色沉淀硫酸钡,所以通过称量硫酸钡的质量可以确定SO2的质量,B正确;
C、SO2易溶水,不能通过排水法确定SO2的体积,C不正确;
D、SO2不能溶解在饱和的亚硫酸氢钠溶液中,所以可以用排饱和NaHSO3溶液的方法测定其产生气体的体积,D正确,答案选AC。
(2)要排除空气参与反应,可在反应之前先通入氮气一段时间,将装置中的空气排出。即正确的操作是打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。
(3)根据猜想1和2可知,猜想3应该是SO2和Fe3+、酸性条件下NO3-都反应。
①铁离子具有氧化性,能把SO2氧化生成硫酸,进而生成硫酸钡白色沉淀,反应的离子方程式是Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+。要验证该反应,则还应进一步确认生成的新物质亚铁离子,所以其实验操作及现象是取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,猜想1合理。
②要验证猜想2正确,则需要排除阳离子铁离子的干扰,因此只需将装置B中的Fe(NO3)3溶液替换为6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液,即答案选c。2、硝酸和铁离子的性质;物质的检验;实验条件的控制以及实验方案的设计等

练习册系列答案
相关题目
 O2
O2