��Ŀ����
�ճ�����ˮ��NO3һ�ĺ�����ˮ�������������Ҫ��֮һ���ﵽһ��Ũ��ʱ������ཡ������Σ����Ϊ�˽�������ˮ��NO3һ��Ũ�ȣ�ij��ȤС��������·�����
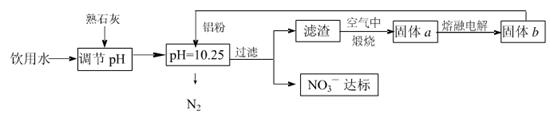
��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�
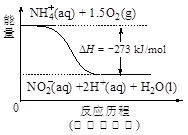
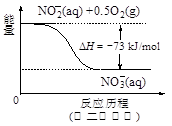
��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ

��ش��������⣺
��1���÷����ڵ���pHʱ����pH������С������� �������ʽ��͡�
��2����֪���˺�õ�����Һ�м���������Ԫ�ء�������Һ�����ۺ�NO3һ��Ӧ�����ӷ���ʽΪ ��
�������ڿ��������չ������漰����ط�Ӧ����ʽΪ
��3����H2����ԭ��Ҳ�ɽ�������ˮ��NO3����Ũ�ȣ���֪��Ӧ�еĻ�ԭ���������������ɲ������ѭ���������ԭ�������ӷ���ʽΪ ��
��4������ˮ�е�NO3�� ��Ҫ������NH4������֪�����������£�NH4�� ����������Ӧ��������NO3�� ��������Ӧ�������仯ʾ��ͼ���£�
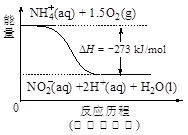
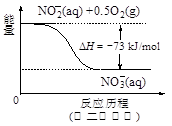
��д��1 mol NH4�� (aq)ȫ��������NO3�� (aq)���Ȼ�ѧ����ʽ�� ��
��5������a���ڵ��ʱ������ӦʽΪ
��1��������Al��(2��)
��2����10Al+6NO3��+18H2O��10Al(OH)3��+3N2��+6OH��(2��)
��4Al+ 3O2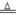 2 Al2 O3 2Al(OH)3
2 Al2 O3 2Al(OH)3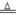 Al2 O3+3 H2O����2�֣�
Al2 O3+3 H2O����2�֣�
��3��5H2+2NO3��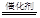 N2��+4H2O+2OH�� (2��)
N2��+4H2O+2OH�� (2��)
����5H2+2NO3����2H��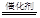 N2��+6H2O��
N2��+6H2O��
��4��NH4�� (aq)��2O2(g)��2H��(aq)��NO3�� (aq)��H2O(l) ��H����346 kJ��mol��1(2��)
��5��Al3++3e-= Al��2�֣�
��2����10Al+6NO3��+18H2O��10Al(OH)3��+3N2��+6OH��(2��)
��4Al+ 3O2
 2 Al2 O3 2Al(OH)3
2 Al2 O3 2Al(OH)3 Al2 O3+3 H2O����2�֣�
Al2 O3+3 H2O����2�֣���3��5H2+2NO3��
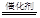 N2��+4H2O+2OH�� (2��)
N2��+4H2O+2OH�� (2��)����5H2+2NO3����2H��
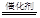 N2��+6H2O��
N2��+6H2O����4��NH4�� (aq)��2O2(g)��2H��(aq)��NO3�� (aq)��H2O(l) ��H����346 kJ��mol��1(2��)
��5��Al3++3e-= Al��2�֣�
�����������1���������ܺ�����ܷ�Ӧ���÷����ڵ���pHʱ����pH������С�������������Al�� �������ʽ��͡���2������������������ӷ���������ԭ��Ӧ���ɹ��壬�����Ϊ���������������ᱻ��ԭΪ������������Һ�����ۺ�NO3����Ӧ�����ӷ���ʽΪ10Al+6NO3��+18H2O=10Al��OH��3+3N2��+6OH�����������ڿ��������չ������漰����ط�Ӧ����ʽΪ4Al+ 3O2
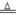 2 Al2 O3��2Al(OH)3
2 Al2 O3��2Al(OH)3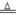 Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3��
Al2 O3+3 H2O����3��H2����ԭ����ˮ��NO3������Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3�� N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ?mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ?mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ?mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-= Al��
N2+4H2O+2OH������4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2�� ��aq��+H2O��l����H=��2736 kJ?mol��1�٣��ڶ����Ȼ�ѧ��ӦΪNO2�� ��aq��+0.5O2��g��=NO3�� ��aq������H=��73kJ?mol��1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3�� ��aq�����Ȼ�ѧ����ʽΪNH4+��aq��+2O2��g��=2H+��aq��+NO3�� ��aq��+H2O��l����H=��346 kJ?mol��1����5������a���ڵ��ʱ����������ӵģ���ӦʽΪAl3++3e-= Al��
��ϰ��ϵ�д�
�����Ŀ
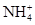 +OH-
+OH- NH3��+H2O
NH3��+H2O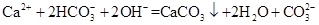
 2C6H5OH��CO32��
2C6H5OH��CO32�� Ce��
Ce�� Ce��
Ce�� Ce��
Ce�� Ce�����ǻ�Ϊͬ��������
Ce�����ǻ�Ϊͬ��������