题目内容
【题目】有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0。

完成下列问题:
(1)Z元素在周期表中的位置是__________________,同周期原子半径最大的元素是____________(填元素符号)。
(2)X的简单氢化物与M的单质,在一定条件下可以发生置换反应,化学方程式为______________,还原产物中含有的化学键类型有____________。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物做燃料。已知X、Y的两种氢化物电子数相等,并且反应时生成两种无毒、无污染的物质。
①写出两种氢化物反应的化学方程式____________________________,反应中氧化剂和还原剂的物质的量之比为____________。
②X的液态氢化物的电子式__________________。
(4)下列说法能证明R、Y非金属性强弱的是____________。
A.R和Y的单质在一定条件下能生成RY2
B.Y单质常温下是气体,R单质是固体
C.Y的氢化物稳定性大于R的氢化物
D.自然界中存在Y单质不存在R单质
【答案】 第三周期、第IIIA族 Na 8NH3+3Cl2![]() N2+6NH4Cl 离子键、共价键 N2H4+2H2O2
N2+6NH4Cl 离子键、共价键 N2H4+2H2O2![]() N2+4H2O 2∶1
N2+4H2O 2∶1 ![]() C
C
【解析】有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0,则R为硅,再由表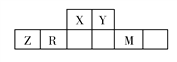 确定X为N,Y为O,Z为Al,M为Cl。
确定X为N,Y为O,Z为Al,M为Cl。
(1)Z为Al元素在周期表中的位置是第三周期、第IIIA族,同周期原子半径从左到右,由大到小,故同周期原子半径最大的元素是Na(填元素符号)。(2)X的简单氢化物是氨气,与Cl2的单质,在一定条件下可以发生置换反应,氯气具有强氧化性,化学方程式为8NH3+3Cl2![]() N2+6NH4Cl,还原产物NH4Cl中含有的化学键类型有离子键、共价键。
N2+6NH4Cl,还原产物NH4Cl中含有的化学键类型有离子键、共价键。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物做燃料。已知X、Y的两种氢化物电子数相等,两种氢化物分别是N2H4,H2O2,并且反应时生成两种无毒、无污染的物质,N2和H2O。①两种氢化物反应的化学方程式 N2H4+2H2O2![]() N2+4H2O,氧化剂H2O2,还原剂为 N2H4,氧化剂和还原剂的物质的量之比为2:1。②X的液态氢化物的电子式
N2+4H2O,氧化剂H2O2,还原剂为 N2H4,氧化剂和还原剂的物质的量之比为2:1。②X的液态氢化物的电子式![]() 。(4)A、R和Y的单质在一定条件下能生成RY2,并不能说明R和Y哪个是氧化剂,故A错误;B、Y单质常温下是气体,R单质是固体,下金属性没有必然联系,故 B错误;C.Y的氢化物稳定性大于R的氢化物,元素的非金属性越强,气态氢化物越稳定,故C正确;D、自然界中存在Y单质不存在R单质,只能说明两种元素的存在形态,故D错误;故选C。
。(4)A、R和Y的单质在一定条件下能生成RY2,并不能说明R和Y哪个是氧化剂,故A错误;B、Y单质常温下是气体,R单质是固体,下金属性没有必然联系,故 B错误;C.Y的氢化物稳定性大于R的氢化物,元素的非金属性越强,气态氢化物越稳定,故C正确;D、自然界中存在Y单质不存在R单质,只能说明两种元素的存在形态,故D错误;故选C。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】下列内容与结论不对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | 该过程的ΔS<0 |
B | 硝酸铵溶于水可自发进行 | 因为ΔS>0 |
C | 一个反应的ΔH>0、ΔS>0 | 该反应一定不能自发进行 |
D | H2(g)+F2(g)=2HF(g) ΔH=-271 kJ·mol-1、 ΔS=8 J·mol-1·K-1 | 该反应在任何温度下均可自发进行 |
A.AB.BC.CD.D