题目内容
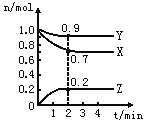
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.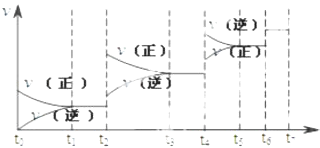
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
【答案】升高温度;增大压强;t3~t4
【解析】解:①该反应为体积增大的吸热反应,t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,则改变条件为升高温度;
t4~t6段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,则改变条件为增大压强;
②平衡正向移动,CO的含量升高,t2时升高温度平衡正向移动,至t3~t4平衡时含量达最高,t2时增大压强,平衡逆向移动,CO含量又减少;
故答案为:①升高温度;增大压强;②t3~t4;
①能使正逆反应速率增大的条件有:催化剂、升高温度、增大压强;结合平衡移动确定条件;
②要使混合物中CO的含量最高,则应为平衡正移后所达到的新的平衡点时候的浓度。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
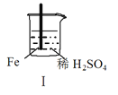
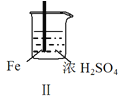
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强