题目内容
(10分) 化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。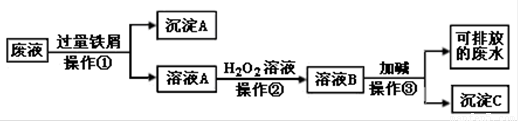
(1)废液经操作①得到的沉淀A中含有的金属单质是 ;
(2)写出操作①的反应离子方程式 ; 。
(3)在操作②中观察到的实验现象是 。
(4)操作③中发生主要反应的离子方程式为 。
(1)Fe 、Cu (2) 2Fe3+ + Fe = 3Fe2+ ;Cu2+ + Fe =" Cu" + Fe2+
(3)溶液由浅绿色变为黄色 (4) Fe3+ + 3OH- = Fe(OH)3↓
【解析】
试题分析:含有Fe3+、Cu2+的废液中,加入过量铁屑,发生反应 :2Fe3+ + Fe = 3Fe2+ ;Cu2+ + Fe =" Cu" + Fe2+,过滤后,得到沉淀A,其中含有铜和铁的单质,并得到滤液溶液A,其中含有Fe2+,加入H2O2溶液,Fe2+被氧化成Fe3+,溶液颜色由浅绿色变为黄色,向该溶液中加碱,发生反应:Fe3+ + 3OH- = Fe(OH)3↓ ,得到Fe(OH)3沉淀。
考点:废液回收处理,Fe的还原性和Fe3+的氧化性。
点评:本题通过废液回收处理过程考查学生对Fe的还原性和Fe3+的氧化性的掌握,解题时需要对每一步的化工流程用化学反应或化学原理来推断这样设计的原因,推断下一步设计的意图。需要学生熟练掌握物质之间的化学反应,而这一题需要牢记双氧水这一种绿色的氧化剂。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有______。
| A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭 |
| B.测量溶液的pH时,应先将pH试纸润湿 |
| C.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
①a g绿矾的实际质量为________ g。
②上述操作步骤的正确顺序为__________________。
③若配制时遗漏步骤④,会使所配溶液的浓度________(填“偏高”“偏低”或“无影响”)。
④若加蒸馏水时不慎超过刻度线,处理方法是________________;若操作步骤②时有溶液溅在容量瓶外,处理方法是________________。