题目内容
(10分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
(1)A Na, B Al, C Si, D P , E Cl
(2) 。
(3) Al(OH)3+NaOH=NaAlO2+2H2O。
(4) H3PO4>H2SiO3。
(2) 。
(3) Al(OH)3+NaOH=NaAlO2+2H2O。
(4) H3PO4>H2SiO3。
 已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al
已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al 根据是原子序数依次增大的短周期元素
A 就是Na
E就是Cl
B就为Al
C元素的最外层电子数比次外层电子数少4 即Si
D元素原子次外层电子数比最外层电子数多3 即P
(1) 见上
(2)

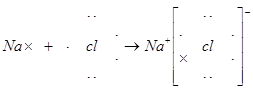
(3) Al(OH)3+NaOH=NaAlO2+2H2O
(4) 根据元素周期律 同周期元素的非金属性逐渐增强 酸性增强
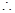 H3PO4>H2SiO3
H3PO4>H2SiO3
练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目

 、
、 、
、 、
、 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)
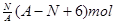
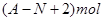
 、
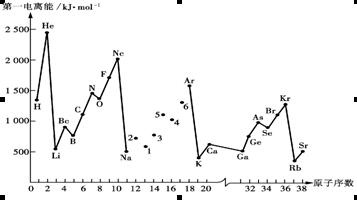
、
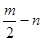 。请回答下列问题:
。请回答下列问题: