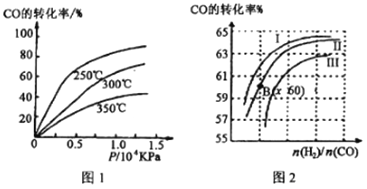
题目内容
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,若缓缓加入稀硫酸直至过量,整个过程中混合溶液中的导电能力(用I表示)可近似地用下图中的曲线表示的是( ) 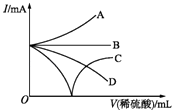
A.A
B.B
C.C
D.D
【答案】C
【解析】解:电解质溶液导电性与离子浓度成正比,向Ba(OH)2溶液中逐滴加入稀硫酸,若缓缓加入稀硫酸直至过量,反应的离子方程式为:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O,随着反应进行,溶液中离子浓度减小,则溶液导电性逐渐减弱,当两种溶液恰好完全反应时生成硫酸钡和水,所以溶液相当于纯水,导电性为0,过量后溶液中离子浓度增大,导电性增强,故选C.
电解质溶液导电性与离子浓度成正比,加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强,据此分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
【题目】下列观察目的与实验操作-致的是
观察目的 | 实验操作 | |
A | 钠的密度比水小 | 将-小块钠放入盛水的烧杯中 |
B | 钠有强还原性 | 将钠放置在煤油中 |
C | 钠有较小的硬度 | 将钠放在坩埚中加热 |
D | 钠的熔点较低 | 用小刀切开金属钠 |
A.AB.BC.CD. D