题目内容
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
Ⅰ、(1)④②③① (2)5×10-7 18:7
Ⅱ、(1)放热 (2)2.5<x<3.5 (3)2m+n/2
【解析】Ⅰ、(1)这四种溶液中,其中①、②、③对水的电离起到抑制作用,只有④对水的电离起到促进作用,所以④中H+浓度大,由水的离子积可计算①中C(H+)=5×10-14mol/L、②C(H+)>10-13mol/L、③C(H+)=10-13mol/L,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①。
(2)纯水显中性,所以C(H+)= C(OH-)或者由水的电离方程式知,水电离的C(H+)= C(OH-),所以纯水中的C(OH-)= C(H+)=5×10-7mol/L。若温度保持不变,则KW=25×10-14,依题可列等式: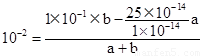 ,解得
,解得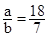 。
。
Ⅱ、(1)若x=5.5,则加入物质总的物质的量为6.5﹢5.5+2=14mol>12mol,则降温平衡右移,正反应为放热反应。
(2)依题意,平衡逆向移动,且保持容器内气体的总物质的量为12mol,则有6.5﹢x+2<12mol, x的取值为x<3.5mol;又因为该反应是可逆反应,不可能进行到底,即反应物不可能完全转化,当反应逆向进行时,假使2.0molC完全转化,将得到1molA和2molB,则有(6.5+1)+(x+2)=12mol,解x=2.5mol。综上所述,得x的取值范围为2.5<x<3.5。
(3)经分析在恒温恒容条件下,D、E两种气体按1∶2的物质的量之比充入,和向容器中投入m molD,n molF和一定物质的量的E,达到平衡状态时,D的体积分数相等,这两个平衡状态是等效平衡。依题可得以下①②③为等效平衡:
D(g) + E(g)  2F(g)
2F(g)
① x 2x 0
② m y n
③ m+0.5n y+0.5n 0
则有关系式: (m+0.5n):(y+0.5n )=x:2x=1 :2
解得 y=2m+0.5n

 阶梯计算系列答案
阶梯计算系列答案 嫦娥三号探测器已于2013年12月2日凌晨1:30分在四川省西昌卫星发射中心使用长征三号乙增强型运载火箭发射成功.火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2,三子级则使用效能更高的液氢(H2)和液氧(O2).下列说法正确的是( )
嫦娥三号探测器已于2013年12月2日凌晨1:30分在四川省西昌卫星发射中心使用长征三号乙增强型运载火箭发射成功.火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2,三子级则使用效能更高的液氢(H2)和液氧(O2).下列说法正确的是( )| A、N2O4在反应中被氧化 | B、(CH3)2NNH2具有还原性 | C、反应中1mol N2O4得到4mol e- | D、液氢与液氧的反应中,液氢与液氧的体积比为 2:1 |
(共12分)配制250mL 1.0mol/L NaOH溶液,请回答下列问题:
⑴在下列仪器中:A 托盘天平 B 量筒 C烧杯 D 玻璃棒 E 漏斗 F 500mL容量瓶
G 药匙 H 250mL容量瓶 I 胶头滴管 J 坩埚
需要用到的仪器有
⑵所需NaOH固体质量为 克
⑶配制的实验步骤如下:
①计算 ②称量 ③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀
其中第③、④、⑤步实验操作都要用到玻璃棒,作用分别是 , ,
。
⑷在容量瓶内确定溶液体积的过程中,完成后期加入少量水的做法是
;
下列各项中,可能导致实际浓度偏高的是 (填标号)
| A.在天平托盘上垫纸,将NaOH放在纸上称量 |
| B.NaOH溶解时放出大量的热,未冷却立即配制溶液 |
| C.溶解NaOH固体之后的烧杯未洗涤 |
| D.向容量瓶中转移液体时不慎洒出 |
⑹将取出的10mL溶液加水稀释到100mL,稀释后溶液中N
 aOH的物质的量浓度为 。
aOH的物质的量浓度为 。 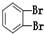 ⑨235U ⑩
⑨235U ⑩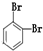
 (12)
(12)
 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。 键有_______mol和形成
键有_______mol和形成 键有_______mol。
键有_______mol。