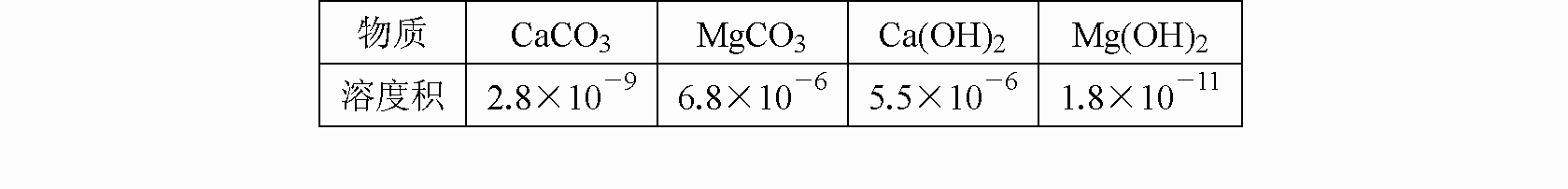题目内容
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的PH最低应为
分析:(1)根据贝壳(主要成分是CaCO3)的溶解性分析;把CaCO3转化为CaO,CaO能与水反应生成碱;
(2)模拟生产过程,烧碱也可以沉淀镁离子,若加入的是纯碱碳酸钠,会生成碳酸镁,加入氢氧化钠溶液,依据碳酸镁和氢氧化镁沉淀溶度积计算可知,氢氧化镁溶解度小于碳酸镁,可以实现沉淀转化生成氢氧化镁;
(3)根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),结合已知离子浓度计算.
(2)模拟生产过程,烧碱也可以沉淀镁离子,若加入的是纯碱碳酸钠,会生成碳酸镁,加入氢氧化钠溶液,依据碳酸镁和氢氧化镁沉淀溶度积计算可知,氢氧化镁溶解度小于碳酸镁,可以实现沉淀转化生成氢氧化镁;
(3)根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),结合已知离子浓度计算.
解答:解:(1)已知贝壳(主要成分是CaCO3)的难溶于水,而且比MgCO3还要难溶,所以将CaCO3其直接投入海水中不能产生MgCO3;把CaCO3转化为CaO,其反应方程式为:CaCO3
CaO+CO2↑,CaO能与水反应生成碱;
故答案为:不能;贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3;CaCO3
CaO+CO2↑;
(2)模拟该生产过程,但实验室无石灰,用烧碱也可以沉淀镁离子.Mg2++2OH-=Mg(OH)2↓,若加入的是纯碱碳酸钠,可以反应生成微溶于水的碳酸镁沉淀,到的混合体系中加入过量的烧碱溶液,氢氧化镁溶解度小于碳酸镁,实现沉淀转化生成氢氧化镁沉淀,过程中反应的离子方程式为:Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg(OH)2+CO32-;
故答案为:可以,能,Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg(OH)2+CO32-;
(3)已知某地海水中的镁离子的浓度为1.8×10-3 mol?L-1,则c2(OH-)=
,c(OH-)=
=1.0×10-4 mol?L-1,
则c(H+)=1.0×10-10 mol?L-1,所以pH=10;
故答案为:10;
| ||
故答案为:不能;贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3;CaCO3
| ||
(2)模拟该生产过程,但实验室无石灰,用烧碱也可以沉淀镁离子.Mg2++2OH-=Mg(OH)2↓,若加入的是纯碱碳酸钠,可以反应生成微溶于水的碳酸镁沉淀,到的混合体系中加入过量的烧碱溶液,氢氧化镁溶解度小于碳酸镁,实现沉淀转化生成氢氧化镁沉淀,过程中反应的离子方程式为:Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg(OH)2+CO32-;
故答案为:可以,能,Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg(OH)2+CO32-;
(3)已知某地海水中的镁离子的浓度为1.8×10-3 mol?L-1,则c2(OH-)=
| Ksp[Mg(OH)2] |
| c(Mg2+) |
|
则c(H+)=1.0×10-10 mol?L-1,所以pH=10;
故答案为:10;
点评:本题考查了溶度积常数的应用、守恒法在计算中的应用等,侧重考查学生分析问题的能力、解决问题的能力,题目难度中等.

练习册系列答案
相关题目
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10–9 |
6.8×10–6 |
5.5×10–6 |
1.8×10–11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 (填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 (用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为 。