题目内容
将一定量的CO2气体通入2 L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).
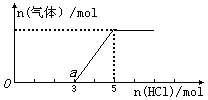
(1)O点溶液中所含溶质的化学式为_____________,
(2)O到a点发生反应的离子方程式:____________________________________.
(3)标准状况下通入CO2气体的体积为_____L, NaOH溶液的物质的量浓度为__________________mol·L-1.

(1)O点溶液中所含溶质的化学式为_____________,
(2)O到a点发生反应的离子方程式:____________________________________.
(3)标准状况下通入CO2气体的体积为_____L, NaOH溶液的物质的量浓度为__________________mol·L-1.
(1)NaOH Na2CO3 (2) OH- + H+ = H2O CO32-+ H+ = HCO3-
(3)44.8 2.5(每空2分)
(3)44.8 2.5(每空2分)
(1)由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaCl=NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑。根据图像可知,生成CO2消耗盐酸的物质的量小于前面消耗的,这说明溶液中的溶质是氢氧化钠和碳酸钠。
(2)根据(1)中的分析可知,O到a点发生反应的离子方程式是OH- + H+ = H2O CO32-+ H+ = HCO3-。
(3)根据图像可知,和碳酸氢钠反应消耗的盐酸是2mol,所以生成的CO2是2mol,标准状况下的体积是44.8L;最终溶液中生成氯化钠是5mol,所以根据原子守恒可知,氢氧化钠元也是5mol,则浓度是5mol÷2L=2.5mol/L。
(2)根据(1)中的分析可知,O到a点发生反应的离子方程式是OH- + H+ = H2O CO32-+ H+ = HCO3-。
(3)根据图像可知,和碳酸氢钠反应消耗的盐酸是2mol,所以生成的CO2是2mol,标准状况下的体积是44.8L;最终溶液中生成氯化钠是5mol,所以根据原子守恒可知,氢氧化钠元也是5mol,则浓度是5mol÷2L=2.5mol/L。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 无关的组合是
无关的组合是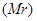 ②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V