题目内容
18.下列有关化学用语正确的是( )| A. | 某元素基态原子的电子排布图 | |
| B. | NH4Cl电子式为 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | α-羟基丙酸(乳酸)的比例模型为: |
分析 A.2p的未成对电子自旋方向应该相同,能够最低进行判断;
B.氯离子电子式中电子没有表示出来;
C.钙离子核外电子总数为18,根据构造原理判断钙离子的基态电子排布式;
D.α-羟基丙酸的结构简式为: ,羟基位于中间碳原子上.
,羟基位于中间碳原子上.
解答 解:A.原子的电子排布图中,该元素2p的未成对电子自旋方向应该相同,正确的电子排布图为: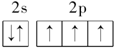 ,故A错误;
,故A错误;
B.氯化铵为离子化合物,铵根离子为复杂阴离子,铵根离子和氯离子都需要标出电荷及最外层电子,氯化铵正确的电子式为: ,故B错误;
,故B错误;
C.钙离子的核外电子总数为18,根据构造原理,Ca2+离子基态电子排布式为:1s22s22p63s23p6,故C正确;
D.α-羟基丙酸的结构简式为: ,羟基应该位于中间C原子上,
,羟基应该位于中间C原子上,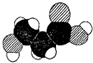 为β-羟基丙酸,故D错误;
为β-羟基丙酸,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握球棍模型与比例模型、电子式、电子排布图、电子排布式等化学用语的表示方法,试题知识点较多、综合性较强,充分考查了学生灵活应用所学知识的能力,有利于培养学生规范答题的能力.

练习册系列答案
相关题目
9.下列有关物质性质的应用错误的是( )
| A. | 明矾水解生成Al(OH)3胶体,用作净水剂 | |
| B. | SO2具有漂白性,常用来漂白纸浆 | |
| C. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污 | |
| D. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 |
13. 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
 铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )
铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O(如图),则下列说法正确的是( )| A. | 放电时负极反应是:Pb-2e-═Pb2+,充电是阴极反应是:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| B. | 闭合K断开K1,电流的流动方向是从B到A | |
| C. | 放电过程中,溶液的pH不断减小 | |
| D. | 放电时,线路上若有1mole-通过,则消耗硫酸也是1mol |
10.全氟丙烷(C3F8)是一种比二氧化碳有效104倍的“超级温室气体”.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标况下,22.4L氦气所含原子数为2NA | |
| C. | 常温常压下,32gO2和32gO3所含氧原子数都是2NA | |
| D. | 常温下5.6g铁投入到足量浓硝酸中反应,转移电子数为0.3NA |
8.下列说法正确的是( )
| A. | H2、D2和T2互称为同素异形体 | B. | 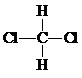 和 和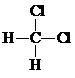 互称为同分异构体 互称为同分异构体 | ||
| C. | 35Cl和37Cl 互称为同位素 | D. | C2H4与C4H8一定能互称为同系物 |

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 .
. .
.


 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. ,
, ,
, .
.