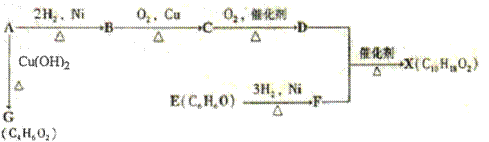
题目内容
向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是( )
| A.白色沉淀是BaSO3 | B.白色沉淀是BaSO4 |
| C.白色沉淀是BaSO3和BaSO4的混合物 | D.FeCl3已全部被SO2还原成FeCl2 |
BD
滤液中滴入KSCN溶液,无明显现象,说明Fe3+与通入的SO2发生了氧化还原反应:2Fe3++SO2+2H2O====2Fe2++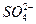 +4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的
+4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的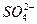 与Ba2+结合生成BaSO4,离子方程式为
与Ba2+结合生成BaSO4,离子方程式为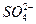 +Ba2+====BaSO4↓,因为盐酸酸性强于H2SO3,HCl能溶解BaSO3,故不会生成BaSO3沉淀。
+Ba2+====BaSO4↓,因为盐酸酸性强于H2SO3,HCl能溶解BaSO3,故不会生成BaSO3沉淀。
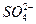 +4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的
+4H+,此反应中Fe3+被还原为Fe2+。通入SO2后生成白色沉淀,说明上述反应生成的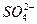 与Ba2+结合生成BaSO4,离子方程式为
与Ba2+结合生成BaSO4,离子方程式为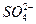 +Ba2+====BaSO4↓,因为盐酸酸性强于H2SO3,HCl能溶解BaSO3,故不会生成BaSO3沉淀。
+Ba2+====BaSO4↓,因为盐酸酸性强于H2SO3,HCl能溶解BaSO3,故不会生成BaSO3沉淀。
练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 Fe(OH)2+2H+。若向硝酸亚铁溶液中加入盐酸,观察到的现象是( )
Fe(OH)2+2H+。若向硝酸亚铁溶液中加入盐酸,观察到的现象是( ) )
)