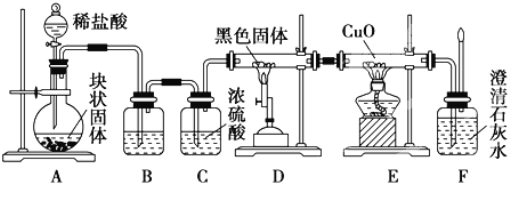
题目内容
【题目】下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:

(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号________、________。
(2)d的元素名称为________,其双原子分子的电子式为________。
(3)图I是表示第三周期8种元素单质的熔点(℃)条形图,已知条形“1”代表Ar,则其中条形“8”代表的是________(填化学式)晶体,1 mol该晶体中含有________mol化学键。

(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”对应的氢化物的名称是__________,空间构型为__________;序列“2”对应的氢化物的结构式是__________,属于________(填“极性”或“非极性”)分子。
【答案】 O2- O![]() 氮 NN Si 2 甲烷 正四面体 H—O—H 极性
氮 NN Si 2 甲烷 正四面体 H—O—H 极性
【解析】根据元素在周期表中的位置,可知a为H,b为Li,c为C,d为N,e为O,f为F,e为Na,h为Al。(1)由氧元素形成的两种带有相同电荷数的阴离子为O2-、O![]() ;(2)d为氮元素,氮分子中N原子之间形成3个共用电子对,且N原子含有1个孤电子对,其电子式为: NN;(3)第三周期8种元素单质的熔点最高的为原子晶体Si,Si晶体中每个Si与4个Si形成4个Si—Si键,每个Si—Si键为2个Si原子共有,故1 mol该晶体中含有Si—Si键1 mol×4×=2 mol;(4)序列“5”对应的氢化物的沸点最低,应为甲烷,其分子为正四面体结构;序列“2”对应的氢化物为水,其结构式为H—O—H,为V形结构,正负电荷中心不重合,为极性分子。
;(2)d为氮元素,氮分子中N原子之间形成3个共用电子对,且N原子含有1个孤电子对,其电子式为: NN;(3)第三周期8种元素单质的熔点最高的为原子晶体Si,Si晶体中每个Si与4个Si形成4个Si—Si键,每个Si—Si键为2个Si原子共有,故1 mol该晶体中含有Si—Si键1 mol×4×=2 mol;(4)序列“5”对应的氢化物的沸点最低,应为甲烷,其分子为正四面体结构;序列“2”对应的氢化物为水,其结构式为H—O—H,为V形结构,正负电荷中心不重合,为极性分子。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目