题目内容
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式 , 其单质与NaOH反应的化学方程式为 .
(2)已知X+、Y2+、Z﹣、W2﹣四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是 , 原子半径由大到小的顺序是 .
(3)A+、B﹣、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B﹣ ![]() C+D↑,则标出A+、B﹣的电子式;比较C和D的稳定性的强弱大小(用化学式表示)
C+D↑,则标出A+、B﹣的电子式;比较C和D的稳定性的强弱大小(用化学式表示)
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4只含有极性键的是 , 既有离子键又有非极性键的是;既有离子键又有极性键的是 .
【答案】
(1)HClO4;Cl2+2NaOH═NaClO+NaCl+H2O
(2)Y>X>Z>W;X>Y>W>Z
(3)![]() ;H2O>NH3
;H2O>NH3
(4)③⑥;④;①⑤
【解析】解:(1)原子核外有3个电子层,其价电子数为7,为Cl元素,最高价氧化物对应水化物为高氯酸,其化学式为HClO4 , 氯气与NaOH的反应为Cl2+2NaOH═NaClO+NaCl+H2O,所以答案是:HClO4;Cl2+2NaOH═NaClO+NaCl+H2O; (2)具有相同的电子层结构的离子,阴前阳下,原子序数大的离子半径小,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是Y>X>Z>W,原子半径由大到小的顺序是X>Y>W>Z,所以答案是:Y>X>Z>W;X>Y>W>Z;(3)都分别含10个电子,由A++B﹣ ![]() C+D↑可知,铵根离子与氢氧根离子反应生成氨气和水,则A+、B﹣的电子式分别为
C+D↑可知,铵根离子与氢氧根离子反应生成氨气和水,则A+、B﹣的电子式分别为 ![]() ,非金属性越强,对应氢化物越稳定,则C和D的稳定性的强弱大小为H2O>NH3 , 所以答案是:
,非金属性越强,对应氢化物越稳定,则C和D的稳定性的强弱大小为H2O>NH3 , 所以答案是: ![]() ;H2O>NH3;(4)①NH4NO3中含离子键、N﹣H和N﹣O极性键;②NaF只含离子键;③CO2中只含极性共价键;④K2O2中含离子键和O﹣O非极性键;⑤NaOH中含离子键和O﹣H极性键; ⑥CH4中只含极性共价键,只含有极性键的是③⑥,既有离子键又有非极性键的是④;既有离子键又有极性键的是①⑤,所以答案是:③⑥;④;①⑤.
;H2O>NH3;(4)①NH4NO3中含离子键、N﹣H和N﹣O极性键;②NaF只含离子键;③CO2中只含极性共价键;④K2O2中含离子键和O﹣O非极性键;⑤NaOH中含离子键和O﹣H极性键; ⑥CH4中只含极性共价键,只含有极性键的是③⑥,既有离子键又有非极性键的是④;既有离子键又有极性键的是①⑤,所以答案是:③⑥;④;①⑤.

【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
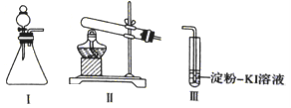
供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
【题目】利用如图所示装置进行下列实验,实验现象与结论均正确的是( )

选项 | 实验试剂 | 实验现象 | 实验结论 | ||
a | b | c | |||
A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A. A B. B C. C D. D