题目内容
【题目】A一J是中学化学中常见的物质,其相互转化关系如下图所示,反应条件均已略去。A、B常温下均为无色液体,且均由两种相同的元素组成;C、F、G均为非金属单质,常温下C、F为无色气体,G可用于制取“84”消毒液;D是应用最广泛的金属;J溶液中滴入KSCN 溶液显红色。

回答下列问题:
(1)A的化学式是_________。
(2)在空气中点燃F,然后把导管缓缓伸入盛满G的集气瓶中,观察到的实验现象是______。
(3)B和G能发生反应,写出反应的离子方程式______。
(4)G和I能发生反应,写出反应的化学方程式,并标出电子转移的方向和数目:______。
【答案】 H2O2 氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成 Cl2+H2O=H++Cl-+HClO 
【解析】根据已知条件,A和B常温下均为无色液体,且均由两种相同的元素组成,则推断A和B为H2O2和H2O,又A分解生成B和气体C(非金属单质),则可推断A为H2O2,B为H2O,C为O2;G均为非金属单质,且G可用于制取“84”消毒液,则G为Cl2。B(H2O)分解得到C(O2)和F,则可推断F为(H2);F(H2)与G(Cl2)反应得到H,则H为为HCl,溶于水后得盐酸;E和H溶液(盐酸)反应得到B(H2O)、I、J,其中J溶液中滴入KSCN 溶液显红色,可推断J为FeCl3,则E中含有Fe元素;D和C(O2)反应得到E,且D为应用最广泛的金属,则D为金属Fe,E为Fe3O4;J(FeCl3)与D(Fe)反应得到I,I为FeCl2.
(1)根据以上分析,A为H2O2;;
(2)在空气中点燃F(H2),然后把导管缓缓伸入盛满G(Cl2)的集气瓶中,实验现象为:氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成;
(3)B(H2O)和G(Cl2)反应生成盐酸和次氯酸,次氯酸是弱酸,离子方程式中不可拆开,故反应的离子方程式为Cl2+H2O=H++Cl-+HClO;
(4)G(Cl2)和I(FeCl2)发生氧化还原反应,反应的化学方程式为2FeCl2 + Cl2 = 2FeCl3,电子转移的方向和数目可以用单线桥或双线桥来表示:单线桥为:为![]() ;双线桥为:
;双线桥为: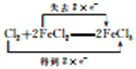 。
。



