题目内容
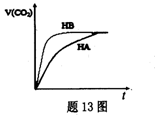
25℃时,将10 mL 0.10 mol/LHA溶液和10 mL 0.10 mol/L HB溶液分别与10 mL 0.10 mol/L NaHCO3溶液混合.实验测得产生的CO2的体积(V)随时间(t)变化的示意图如题13图所示,下列说法正确的是

| A.反应结束后,两溶液中c(A一)> c(B—) |
| B.pH=5.3的NaA与HA的混合溶液中,c(Na+)<c(A一) |
| C.中和体积相同、pH相同的HA和HB溶液,所消耗NaOH的物质的量后者多 |
| D.在同体积同浓度的NaA和NaB溶液中前者的离子总数比后者多 |
B
根据图中可知,HB反应的速率大,说明HB的酸性强于HA的。由于都是恰好反应,所以反应结束后,溶液中含有的溶质是NaA和NaB,酸越强,相应的钠盐越容易水解,因此NaA的水解程度大,则c(A一)<c(B—),A不正确。选项B中溶液显酸性,所以根据电荷守恒可知,c(Na+)<c(A一),B正确。在pH相同的条件下,HA的浓度大于HB,所以HA消耗的氢氧化钠多,C不正确。NaA的水解程度大,则溶液的碱性强。则NaA中氢离子浓度小,由于钠离子浓度相同,所以根据电荷守恒可知,NaB溶液中离子总数多,D不正确,答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目