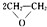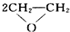题目内容
绿色化学的最大特点在于它是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染.绿色化学主张在通过化学转换获取新物质的过程中尽可能充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染.下列化学反应,不符合绿色化学概念的是( )
分析:根据绿色化学的含义判断,绿色化学是指环境友好化学,即无污染,其核心是从源头上消除污染.
解答:解:A、用碱性的气体氨气来消除硫酸厂尾气中二氧化硫的排放的反应属于化合反应,能充分利用每个原子,具有“原子经济性”,又能够防止污染,符合绿色化学概念,故A不选;
B、消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O的反应中,氮原子被充分利用,又能够防止污染,符合绿色化学概念,故B不选;
C、制CuSO4时,反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中生成了有毒的二氧化硫气体,不符合绿色化学概念,故C选;
D、利用反应2Cu+O2=2CuO;CuO+H2SO4(稀)=CuSO4+H2O来制取硫酸铜时,不会产生有毒的气体,且消耗硫酸量较少,硫酸利用率高,符合绿色化学概念,故D不选.
故选C.
B、消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O的反应中,氮原子被充分利用,又能够防止污染,符合绿色化学概念,故B不选;
C、制CuSO4时,反应Cu+2H2SO4(浓)
| ||
D、利用反应2Cu+O2=2CuO;CuO+H2SO4(稀)=CuSO4+H2O来制取硫酸铜时,不会产生有毒的气体,且消耗硫酸量较少,硫酸利用率高,符合绿色化学概念,故D不选.
故选C.
点评:环保问题已经引起了全球的重视,是考试热点问题,化学上提倡绿色化学工艺,要求从源头上杜绝污染.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目