题目内容
(1)①要配制500mL 0.200mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外还有______.需要98%的浓硫酸______mL.
②下列操作会使所配的溶液浓度偏小的是______(填代号).
A.用量筒取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视观察液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外
(2)如图是一个实验室制到氯气并以氯气为原料进行特定反应的装置
①A是氯气发生装置,其中发生的离子方程式为______.
②实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D.D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl.则该反应的化学方程式为______ CO2+4HCl

【答案】分析:(1)①根据配制溶液的实验操作过程选择所需的仪器;
可设出溶液的体积,利用m=ρV求出质量,根据溶液稀释前后溶质质量不变来列式解答;
②分析操作对溶质的物质的量或对溶液的体积的影响,根据c=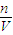 分析判断;
分析判断;
(2)①A中反应加热进行,应是二氧化锰与浓盐酸反应生成氯化锰、氯气与水;
②加入D装置的物质有氯气、水蒸气,与碳在加热条件下反应生成二氧化碳与HCl;
③尾气中含有未反应的氯气,直接排放会污染空气,E装置吸收氯气,用氢氧化钠溶液,并倒置的漏斗防止倒吸;
④A处仍有Cl2产生,则B的作用是储存氯气;
⑤HCl的挥发,盐酸反应,盐酸变稀与MnO2不反应.
解答:解:(1)配制步骤有:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴签等操作,一般用量筒量取(还需胶头滴管),在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,振荡、摇匀后,装瓶、贴签.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、500mL容量瓶,
故还需要的仪器有:玻璃棒、500mL容量瓶、胶头滴管,
设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=0.5L×0.2mol?L-1×98g/mol,解得V=5.4ml,
故答案为:玻璃棒、500mL容量瓶、胶头滴管;5.4mL;
②A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内,热溶液的体积偏大,一但冷却下来,溶液的体积偏小,浓度偏大,故A不符合;
B、稀释硫酸所用的小烧杯未洗涤,因烧杯内壁沾有溶质,所以溶质的质量偏小,浓度偏小,故B符合;
C、定容时俯视观察液面,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故C不符合;
D、用蒸馏水洗涤后的容量瓶未干燥,对溶液的体积无影响,浓度不变,故D不符合;
E、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外,由于是均匀的溶液,对溶液的浓度无影响,故E不符合;
故答案为:B;
(2)①A中反应加热进行,应是二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;
②加入D装置的物质有氯气、水蒸气,与碳在加热条件下反应生成二氧化碳与HCl,反应方程式为:2Cl2+2H2O+C CO2+4HCl,
CO2+4HCl,
故答案为:2Cl2+2H2O+C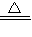 CO2+4HCl;
CO2+4HCl;
③尾气中含有未反应的氯气,直接排放会污染空气,E装置吸收氯气,用氢氧化钠溶液,并倒置的漏斗防止倒吸,故E除的装置为: ,
,
故答案为: ;
;
④A处仍有Cl2产生,则B的作用是储存氯气,
故答案为:储存氯气;
⑤随反应进行HCl消耗、且HCl的挥发,盐酸变稀与MnO2不反应,则生成的Cl2的物质的量总是小于0.03mol,
故答案为:随反应进行HCl消耗、且HCl的挥发,盐酸变稀与MnO2不反应.
点评:本题考查一定物质的量浓度溶液的配制、氯气的实验室制备等,难度中等,需要学生具有扎实的基础知识与运用知识分析解决问题的能力.
可设出溶液的体积,利用m=ρV求出质量,根据溶液稀释前后溶质质量不变来列式解答;
②分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
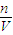 分析判断;
分析判断;(2)①A中反应加热进行,应是二氧化锰与浓盐酸反应生成氯化锰、氯气与水;
②加入D装置的物质有氯气、水蒸气,与碳在加热条件下反应生成二氧化碳与HCl;
③尾气中含有未反应的氯气,直接排放会污染空气,E装置吸收氯气,用氢氧化钠溶液,并倒置的漏斗防止倒吸;
④A处仍有Cl2产生,则B的作用是储存氯气;
⑤HCl的挥发,盐酸反应,盐酸变稀与MnO2不反应.
解答:解:(1)配制步骤有:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴签等操作,一般用量筒量取(还需胶头滴管),在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,振荡、摇匀后,装瓶、贴签.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、500mL容量瓶,
故还需要的仪器有:玻璃棒、500mL容量瓶、胶头滴管,
设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=0.5L×0.2mol?L-1×98g/mol,解得V=5.4ml,
故答案为:玻璃棒、500mL容量瓶、胶头滴管;5.4mL;
②A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内,热溶液的体积偏大,一但冷却下来,溶液的体积偏小,浓度偏大,故A不符合;
B、稀释硫酸所用的小烧杯未洗涤,因烧杯内壁沾有溶质,所以溶质的质量偏小,浓度偏小,故B符合;
C、定容时俯视观察液面,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故C不符合;
D、用蒸馏水洗涤后的容量瓶未干燥,对溶液的体积无影响,浓度不变,故D不符合;
E、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外,由于是均匀的溶液,对溶液的浓度无影响,故E不符合;
故答案为:B;
(2)①A中反应加热进行,应是二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;
②加入D装置的物质有氯气、水蒸气,与碳在加热条件下反应生成二氧化碳与HCl,反应方程式为:2Cl2+2H2O+C
 CO2+4HCl,
CO2+4HCl,故答案为:2Cl2+2H2O+C
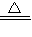 CO2+4HCl;
CO2+4HCl;③尾气中含有未反应的氯气,直接排放会污染空气,E装置吸收氯气,用氢氧化钠溶液,并倒置的漏斗防止倒吸,故E除的装置为:
 ,
,故答案为:
 ;
;④A处仍有Cl2产生,则B的作用是储存氯气,
故答案为:储存氯气;
⑤随反应进行HCl消耗、且HCl的挥发,盐酸变稀与MnO2不反应,则生成的Cl2的物质的量总是小于0.03mol,
故答案为:随反应进行HCl消耗、且HCl的挥发,盐酸变稀与MnO2不反应.
点评:本题考查一定物质的量浓度溶液的配制、氯气的实验室制备等,难度中等,需要学生具有扎实的基础知识与运用知识分析解决问题的能力.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 A
A  B
B 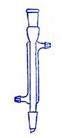 C
C  D
D