题目内容
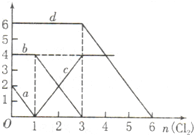 向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )| A、d曲线代表溶液中Br-变化情况 | B、原溶液中FeI2的物质的量为2mol | C、原溶液中n(Fe2+):n(Br-)=2:3 | D、当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
分析:首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,以此解答该题.
解答:解:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,则通入氯气,先与碘离子反应,再与Fe2+反应,a对应氯气与碘离子的反应,c对应氯气与亚铁离子反应,当加3mol氯气时溴离子开始反应,则d曲线代表溶液中Br-变化情况,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,FeI2的物质的量为1mol,故B错误;
C.由B可知,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(Br-)=2:3,故C正确;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确.
故选B.
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,FeI2的物质的量为1mol,故B错误;
C.由B可知,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(Br-)=2:3,故C正确;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确.
故选B.
点评:本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度较大,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点,答题时注意体会.

练习册系列答案
相关题目
在含有FeBr2和FeI2的混合溶液中,通入一定量的Cl2,再滴加KSCN溶液,则反应后的溶液中最不可能存在的离子是( )
| A、I- | B、Fe2+ | C、Cl- | D、Br- |
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ | B、在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ | C、在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 | D、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
向含有FeBr2、FeI2的溶液中通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变为红色,则下列叙述不正确的是( )
| A、通入氯气后的溶液中一定不存在I- | B、通入氯气之后原溶液中的Fe2+全部被氧化 | C、原溶液中的Br-可能被氧化 | D、若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色 |