题目内容
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:

(1)写出工业上制取Cl2的化学方程式_____________________________________。
(2)在“反应液I”中加入KOH固体的目的是①_________________,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的化学方程式:______________________。
(4)K2FeO4可作为新型多功能水处理剂的原因是:
①_____________________,②_________________________。
(5)从“反应液II”中分离出K2FeO4后,副产品是_________________(写化学式)。
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为_______mol。
【答案】2NaCl+2H2O![]() 2NaCl+Cl2↑+H2↑与反应液I中多余的Cl2反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2OK2FeO4强氧化剂,杀菌消毒还原产物Fe3+水解生成Fe(OH)3胶体净水KNO3 KCl15
2NaCl+Cl2↑+H2↑与反应液I中多余的Cl2反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2OK2FeO4强氧化剂,杀菌消毒还原产物Fe3+水解生成Fe(OH)3胶体净水KNO3 KCl15
【解析】
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)工业是利用电解饱和食盐水制取氯气。反应方程式为:2NaCl+2H2O![]() 2NaCl+Cl2↑+H2↑;
2NaCl+Cl2↑+H2↑;
(2)由工艺流程可以知道,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO;
(3)根据分析可以知道,Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和氯化钾,反应的化学方程式为2Fe(NO3)3+3KClO+10KOH=2K2FeO4+3KCl+6KNO3+5H2O;
(4)K2FeO4具有强氧化性,可杀菌消毒,同时被还原形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀,所以K2FeO4可作为新型多功能水处理剂的原因是①K2FeO4具有强氧化性,可杀菌消毒;②还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀;
(5)由工艺流程及③可以知道,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl;
(6)根据反应Cl2+2OH-=Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,1.98kgK2FeO4的物质的量为10mol,根据关系式可以知道氯气的物质的量为15mol。

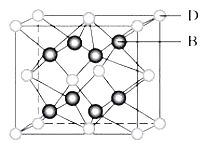
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D