题目内容
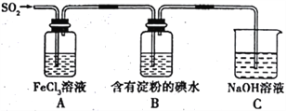
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
【答案】平衡压强,使甲、乙中的气体可顺利进入BaCl2溶液中 排除溶解的O2防止将SO2在溶液中氧化为SO42-而对实验产生干扰 Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O CaO + NH3·H2O=Ca(OH)2+NH3↑(或NH3·H2O![]() NH3↑ +H2O ) 在酸性条件下不能生成BaSO3沉淀 SO2+2NH3+H2O+Ba2+=BaSO3↓+2NH4+ SO2可能对环境产生污染(或没尾气处理装置)、通NH3时有可能倒吸
NH3↑ +H2O ) 在酸性条件下不能生成BaSO3沉淀 SO2+2NH3+H2O+Ba2+=BaSO3↓+2NH4+ SO2可能对环境产生污染(或没尾气处理装置)、通NH3时有可能倒吸
【解析】
本题的实验目的是探究SO2与BaCl2反应生成BaSO3沉淀的条件。甲装置中Na2SO3与浓H2SO4反应制备SO2;为了防止BaCl2溶液中溶解的O2与SO2作用产生的SO42-干扰实验的判断,实验前需要将BaCl2溶液煮沸赶尽溶解氧;通过实验现象得出在酸性条件下SO2不能与BaCl2反应生成BaSO3沉淀;装置乙中产生的碱性气体为NH3,由CaO和氨水作用产生NH3;SO2、NH3通入BaCl2溶液中产生BaSO3沉淀;SO2、NH3都能污染大气,NH3极易溶于水,该装置的不足之处是没有尾气吸收装置、通NH3时可能产生倒吸;根据上述分析作答。
(1)广口瓶中间那根玻璃管的作用是:平衡压强,使甲、乙中的气体可顺利进入BaCl2溶液。
(2)为了防止BaCl2溶液中溶解的O2与SO2作用产生的SO42-干扰实验的判断,实验前需要将BaCl2溶液煮沸,其目的是:排除溶解的O2,防止将SO2在溶液中氧化为SO42-而对实验产生干扰。
(3)甲中Na2SO3与浓H2SO4反应生成Na2SO4、H2O和SO2,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体,该碱性气体为NH3,获得NH3的常用氧化物为CaO、无色液体为氨水,两者反应的化学方程式为:CaO+NH3·H2O=Ca(OH)2+NH3↑。
(5)实验时,将甲中产生的足量SO2通入BaCl2溶液中,始终无沉淀生成,由此说明:酸性条件下SO2不能与BaCl2反应生成BaSO3沉淀。
(6)向上述(5)实验所得溶液中通入NH3,产生白色沉淀,反应的化学方程式为SO2+2NH3+H2O+BaCl2=BaSO3↓+2NH4Cl,反应的离子方程式为SO2+2NH3+H2O+Ba2+=BaSO3↓+2NH4+。
(7)SO2、NH3都能污染大气,该装置的不足之处是没有尾气吸收装置;NH3极易溶于水,该装置的不足之处是装置中d导管插入BaCl2溶液中,通NH3时可能产生倒吸。

 阅读快车系列答案
阅读快车系列答案