题目内容
下表是实验室制备气体的有关内容:
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:


①通入氯气后,A中的现象是
②C装置中发生反应的离子方程式为:
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
(4)若用排空气法收集Cl2,在右边方框内画出气体收集装置图.
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | Ⅳ Ⅳ |
| ② | 制备氨气 | NH4Cl→NH3 | Ⅱ Ⅱ |
| ③ | 制备氯气 | HCl→Cl2 | Ⅰ或Ⅳ Ⅰ或Ⅳ |
Cl2
Cl2
(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是NH3
NH3
.(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:


①通入氯气后,A中的现象是
溶液变蓝色
溶液变蓝色
,整套实验装置存在的明显缺陷是无尾气吸收装置;
无尾气吸收装置;
.②C装置中发生反应的离子方程式为:
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化
(4)若用排空气法收集Cl2,在右边方框内画出气体收集装置图.
分析:(1)依据三种气体制备的试剂和原理分析,需要氧化剂的是制备氯气;氨气是碱性气体;
(2)依据制备气体的试剂状态,反应条件分析判断,固体+液体加热制气体的装置选择Ⅰ;固体+固体加热制气体的装置选择Ⅱ;固体+液体不加热制气体装置且随时进行随时停止的装置选Ⅲ;固体+液体不加热制气体的装置为Ⅳ;
(3)①根据氯气有氧化性,能和碘化钾反应生成碘单质,碘单质与淀粉变蓝;氯气有毒,不能直接排空,要用尾气处理装置处理;
②根据氯气有氧化性,能将二价铁氧化生成三价铁;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子;如果亚硫酸钠被氧化会生成硫酸钠,先排除亚硫酸根离子的干扰,然后根据硫酸根离子的检验方法检验即可;
(4)根据氯气比空气重,用向上排气法收集,氯气有毒需要连接尾气吸收装置;
(2)依据制备气体的试剂状态,反应条件分析判断,固体+液体加热制气体的装置选择Ⅰ;固体+固体加热制气体的装置选择Ⅱ;固体+液体不加热制气体装置且随时进行随时停止的装置选Ⅲ;固体+液体不加热制气体的装置为Ⅳ;
(3)①根据氯气有氧化性,能和碘化钾反应生成碘单质,碘单质与淀粉变蓝;氯气有毒,不能直接排空,要用尾气处理装置处理;
②根据氯气有氧化性,能将二价铁氧化生成三价铁;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子;如果亚硫酸钠被氧化会生成硫酸钠,先排除亚硫酸根离子的干扰,然后根据硫酸根离子的检验方法检验即可;
(4)根据氯气比空气重,用向上排气法收集,氯气有毒需要连接尾气吸收装置;
解答:解:(1)利用过氧化氢分解制氧气,利用氯化铵和氢氧化钙固体加热发生复分解反应制氨气,利用二氧化锰氧化浓盐酸制氯气,所以需要氧化剂的是制备氯气,其中氨气是碱性气体化合物,氧气是中性气体单质,氯气是氧化性气体单质;从反应原理看,明显不同于其他两种气体的是制备氨气利用的是复分解反应;
故答案为:Cl2;NH3;
(2)过氧化氢分解制氧气不需要加热选择Ⅳ,利用氯化铵和氢氧化钙固体加热发生复分解反应制氨气,选择Ⅱ,利用二氧化锰氧化浓盐酸加热制氯气选择Ⅰ,或用高锰酸钾和浓盐酸不加热反应制氯气,选择Ⅳ;
故答案为:
(3)①氯气有氧化性,能和碘化钾反应生成碘单质,碘单质与淀粉变蓝,所以通入氯气后,A中的现象是溶液变蓝色;氯气有毒,不能直接排空,要用尾气处理装置处理,
故答案为:溶液变蓝色;无尾气吸收装置;
②氯气有氧化性,能将二价铁氧化生成三价铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
(4)用排空气法收集Cl2,氯气比空气重,用向上排气法收集,氯气有毒需要连接尾气吸收装置,装置图为: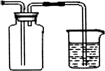
故答案为: ;
;
故答案为:Cl2;NH3;
(2)过氧化氢分解制氧气不需要加热选择Ⅳ,利用氯化铵和氢氧化钙固体加热发生复分解反应制氨气,选择Ⅱ,利用二氧化锰氧化浓盐酸加热制氯气选择Ⅰ,或用高锰酸钾和浓盐酸不加热反应制氯气,选择Ⅳ;
故答案为:
| 编号 | 发生装置 |
| ① | Ⅳ |
| ② | Ⅱ |
| ③ | Ⅰ或Ⅳ |
故答案为:溶液变蓝色;无尾气吸收装置;
②氯气有氧化性,能将二价铁氧化生成三价铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③根据氯气有强氧化性,能将亚硫酸根离子氧化生成硫酸根离子:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
(4)用排空气法收集Cl2,氯气比空气重,用向上排气法收集,氯气有毒需要连接尾气吸收装置,装置图为:

故答案为:
 ;
;点评:本题考查了气体的实验室制法、物质性质的检验等,难度不大,注意根据反应物的状态和反应条件选择反应发生装置.

练习册系列答案
相关题目
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:



