题目内容
5.下列关于氯水的叙述中,正确的是( )| A. | 新制氯水中只含有 Cl2和 H2O 分子 | |
| B. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| C. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
分析 氯气微溶于水,水中因溶解少量氯气而呈黄绿色,氯气与水反应:Cl2+H2O=H++Cl-+HClO,溶液呈酸性,加入AgNO3溶液,会有白色沉淀产生,HClO具有强氧化性、不稳定性和漂白性,加入有色布条,有色布条褪色.
解答 解:A.氯气微溶于水,氯气与水反应:Cl2+H2O=H++Cl-+HClO,新制氯水中含有Cl2、H2O和HClO等分子,故A错误;
B.氯气与水反应:Cl2+H2O=H++Cl-+HClO,加入AgNO3溶液,会有白色沉淀产生,故B错误;
C.HClO具有不稳定性,光照条件下分解生成氧气,故C错误;
D.HClO具有强氧化性和漂白性,加入有色布条,有色布条褪色,故D正确.
故选D.
点评 本题考查氯水的性质,题目难度不大,注意氯气、HClO的性质的理解应用,掌握基础是关键.

练习册系列答案
相关题目
15.设阿伏加德罗常数为NA,一个碳-12原子的质量为ag,一个铁原子的质量为bg,则这种铁原子的相对原子质量是( )
| A. | $\frac{12b}{a}$或b•NA | B. | $\frac{12b}{a}$或a•NA | C. | $\frac{12a}{b}$或a•NA | D. | $\frac{12a}{b}$或b•NA |
13.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间(t)的关系如图2.据此回答下列问题:
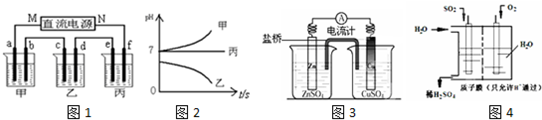
(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
20.下面列出了电解不同物质的电极反应式,其中错误的是( )
| A. | 电解饱和食盐水 阴极:Na++e-═Na | |
| B. | 电镀铜时(电解质溶液为CuSO4溶液) 阳极:Cu-2e-═Cu2+ | |
| C. | 电解熔融NaCl 阴极:Na++e-═Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |
10.给试管里的固体加热,下列操作中错误的是( )
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 加热时不要使试管与灯心相接触 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
17.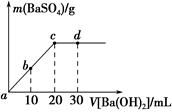 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |