题目内容
18.高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂.(1)H2O2的结构式为H-O-O-H.
(2)下列物质中能使酸性KMnO4溶液褪色的是AD(填选项字母).
A.臭碱(Na2S) B.小苏打(NaHCO3)
C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序.
①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e--→2H++O2↑
还原反应:MnO${\;}_{4}^{-}$+5e-+8H+-→Mn2++4H2O
写出该氧化还原反应的离子方程式5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+KI+H2SO4-→I2+Br2+K2SO4+KBr+H2O.
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是1;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:□KBrO3+□KI+□H2SO4→□
③若转移10mol e-,则反应后生成I2的物质的量为5mol.
分析 (1)H2O2分子结构中含有非极性共价键O-O,结合共价键的形成理论可写出H2O2的结构式;
(2)酸性KMnO4溶液具有强氧化性,是典型的强氧化剂,能使其褪色的物质必须具备较强还原性,只要判断选项中各物质是否有强还原性即可;
(3)①结合氧化还原反应的电子守恒规律,调整氧化反应和还原反应的系数再加合就可以得到反应的离子方程式;
②(1)分析所给五种物质所含元素的化合价,可知Br2是KBrO3的反应产物,此过程发生了还原反应,结合氧化还原反应的“有升必有降”的原则可知KI是反应物,对应的氧化产物是I2,剩下的另二种物质也是产物了;
(2)I2的系数是8,说明还原剂共升高16价(或失16e-),结合升降守恒(或得失守恒),可知还原产物Br2和KBr的系数,再结合原子守恒可配平此反应方程式.
解答 解:(1)H2O2分子结构中含有非极性共价键O-O,另外H与O形成H-O键,可知H2O2的结构式为H-O-O-H,故答案为:H-O-O-H;
(2)硫化钠和乙醇有较强还原性,能使强氧化性的酸性KMnO4溶液褪色,故答案为:AD;
(3)①根据氧化还原的电子守恒规律,将氧化反应的系数乘5,还原反应的系数乘2,再相加可得反应方程式:5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O,
故答案为:5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O;
②(1)分析所给五种物质所含元素的化合价,可知Br2是KBrO3的反应产物,此过程发生了还原反应,结合氧化还原反应的“有升必有降”的原则可知KI是反应物,对应的氧化产物是I2,剩下的另二种物质也是产物了,可得未配平的化学方程式:KBrO3+KI+H2SO4-→I2+Br2+K2SO4+KBr+H2O,
故答案为:KI;I2;Br2;K2SO4;KBr;
(2)①I2的化学计量数是8,说明还原剂共失16e-,KBr的化学计量数是1,说明生成KBr共得6e-,则生成另一还原产物Br2应得10e-,因Br从+5价降为了0价,每生成一个Br2得10e-,故Br2的化学计量数是1,故答案为:1;
②结合原子守恒和电子守恒可配平化学方程式:3KBrO3+16KI+9H2SO4═8I2+Br2+9K2SO4+KBr+9H2O,故答案为:3;16;KI;9;
③结合元素化合价的变化,每生成一个I2分子转移2e-,现转移10mol e-,则反应后生成I2的物质的量为10mol÷2=5mol,故答案为:5 mol.
点评 本题考查分析氧化还原反应,涉及氧化还原反应的配平与电子转移,难度中等,电子守恒是解题的关键.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案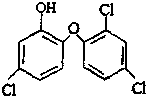 三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )
三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )| A. | 三氯生的分子式是C12H6Cl3O2 | |
| B. | 三氯甲烷与甲烷均无同分异构体 | |
| C. | 1 mol三氯生最多能与6 mol H2反应 | |
| D. | 三氯生它的相对分子质量为289.5g/mol |
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到限度时,正、逆反应速率相等 | |
| C. | 化学反应的限度与时间的长短无关 | |
| D. | 改变外界条件,化学反应的限度不可能改变 |
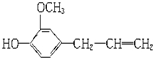 按官能团分类,它不具有哪类物质的性质( )
按官能团分类,它不具有哪类物质的性质( )| A. | 酯 | B. | 酚 | C. | 醚 | D. | 烯烃 |

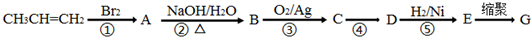
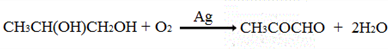 ;
;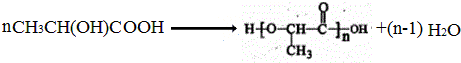 .
. 如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,
如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,