题目内容
标准状况下336 L的NH3溶于1 L水中,所得溶液的质量分数为________,若该溶液的密度为a g/cm3,则物质的量浓度为________。将上述氨水全部转化为NH4Cl,所需4 mol·L-1的盐酸的体积为________。
【答案】
20.32% 11.95a mol·L-1 3.75 L
【解析】氨水的质量分数
w= ×100%=20.32%。
×100%=20.32%。
氨水的物质的量浓度
c(NH3)=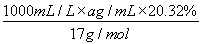 =11.95a mol·L-1。
=11.95a mol·L-1。
NH3+HCl=NH4Cl
n(NH3)=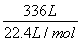 =15 mol,
=15 mol,
n(HCl)=15 mol,
V(HCl)= =
=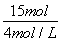 =3.75 L。
=3.75 L。

练习册系列答案
相关题目
标准状况下分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,再加入不同质量的由两种金属组成的同种合金粉末,测量放出气体的体积.另在甲、乙、丙三个容器中加入30.0mL与盐酸同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积.所得数据如下表所示:
根据表中数据不可能得出的结论是( )
| 反应容器 | 甲 | 乙 | 丙 |
| 合金的质量/g | 0.510 | 1.53 | 3.57 |
| 与盐酸反应产生气体的体积/L | 0.560 | 0.672 | 0.672 |
| 与氢氧化钠反应产生气体的体积/L | 0.336 | x | y |
| A、盐酸的物质的量浓度为2 mol?L-1 |
| B、合金可能由镁与铝组成 |
| C、x=2.016 |
| D、y=2.016 |