题目内容
【题目】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。丙烷在室温下燃烧的热化学方程式为______________________。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________;
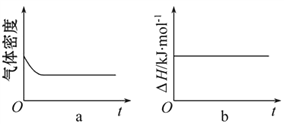
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) ![]() 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是___________。
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是___________。
(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1,在一定条件下发生反应:A(g)+B(g) ![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为_________________。
②A的转化率为___________。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH_____0(填“>”或“<”);若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1,此时v(正)____v(逆)。(填“>”、“<”或“=”)
【答案】 C3H8 (g)+5O2(g)=3CO2(g)+4H2O(g)ΔH=- 2219.8 kJ·mol-1 2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=- 46 kJ·mol-1 acd  50% < =
50% < =
【解析】(1)1mol丙烷的质量为44g,已知1 g丙烷完全燃烧放出50.45 kJ的热量,所以1mol丙烷完全燃烧生成气态水能放出2219.8 kJ的热量。因此,丙烷在室温下燃烧的热化学方程式为C3H8 (g)+5O2(g)=3CO2(g)+4H2O(g)ΔH=- 2219.8 kJ·mol-1。
(2)①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1,②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,① ![]() 2+②得,2CH4(g)+ O2(g)=2CO(g)+4H2(g),所以ΔH=(+260 kJ·mol-1)
2+②得,2CH4(g)+ O2(g)=2CO(g)+4H2(g),所以ΔH=(+260 kJ·mol-1)![]() +(-566 kJ·mol-1)=- 46 kJ·mol-1,则CH4与O2反应生成CO和H2的热化学方程式为2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=- 46 kJ·mol-1;
+(-566 kJ·mol-1)=- 46 kJ·mol-1,则CH4与O2反应生成CO和H2的热化学方程式为2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=- 46 kJ·mol-1;
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) ![]() 2NO2 (g) ,正反应是一个气体体积增大的反应 。在反应过程中,保持压强不变,所以气体的体积逐渐增大,而质量均不变,所以密度逐渐减小,达到化学平衡状态后,密度就保持不变了;该反应的焓变与反应的限度无关,是恒量,不随反应的进程变化;随着反应的发生,正反应速率逐渐减小、逆反应速率逐渐增大,达到化学平衡状态后,正反应速率和逆反应速率相等且保持不变;反应物的转化率逐渐增大,达到化学平衡状态后,转化率达到最大值后保持不变。综上所述,示意图正确且能说明反应达到平衡状态的是acd。
2NO2 (g) ,正反应是一个气体体积增大的反应 。在反应过程中,保持压强不变,所以气体的体积逐渐增大,而质量均不变,所以密度逐渐减小,达到化学平衡状态后,密度就保持不变了;该反应的焓变与反应的限度无关,是恒量,不随反应的进程变化;随着反应的发生,正反应速率逐渐减小、逆反应速率逐渐增大,达到化学平衡状态后,正反应速率和逆反应速率相等且保持不变;反应物的转化率逐渐增大,达到化学平衡状态后,转化率达到最大值后保持不变。综上所述,示意图正确且能说明反应达到平衡状态的是acd。
(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1,在一定条件下发生反应:A(g)+B(g) ![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为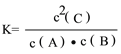 。
。
②高A的转化率为![]() ,则A和B的变化量均为2
,则A和B的变化量均为2 ![]() mol·L-1,C的变化量为4
mol·L-1,C的变化量为4 ![]() mol·L-1,A、B、C的平衡量分别为2(1-
mol·L-1,A、B、C的平衡量分别为2(1- ![]() )mol·L-1、2(1-
)mol·L-1、2(1- ![]() )mol·L-1、4
)mol·L-1、4 ![]() mol·L-1,由平衡常数K=
mol·L-1,由平衡常数K=![]() ,求出A的转化率为50% 。
,求出A的转化率为50% 。
③若升温至T2时,此反应的平衡常数为1,说明正反应是放热反应,则可以判断该反应ΔH<0;若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1,Qc=![]() 1=K,所以该可逆反应恰好处于平衡状态,此时v(正)=v(逆)。
1=K,所以该可逆反应恰好处于平衡状态,此时v(正)=v(逆)。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案