题目内容
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)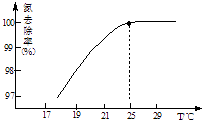
【答案】
(1)﹣622.2;△H>0,△S<0;NaClO+2NH3=N2H4+NaCl+H2O
(2)2HSO4﹣﹣2e﹣═S2O82﹣+2H+
(3)升高温度NH3的溶解度降低,有利于NH3的逸出;氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
(4)2800cV
【解析】解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJmol﹣1b、2H2(g)+O2(g)═2H2O(l);△H=﹣571.6kJmol﹣1
依据盖斯定律b﹣a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=﹣622.2KJ/mol,
所以答案是:﹣622.2②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H﹣T△S>0,则反应△S<0,△H>0,所以答案是:△H>0,△S<0;③用次氯酸钠氧化氨,可以得到N2H4和氯化钠,方程式为:NaClO+2NH3=N2H4+NaCl+H2O,所以答案是:NaClO+2NH3=N2H4+NaCl+H2O;(2)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , HSO4﹣离子在阳极失电子生成S2O82﹣ , 电极反应为:2HSO4﹣﹣2e﹣═S2O82﹣+2H+ , 所以答案是:2HSO4﹣﹣2e﹣═S2O82﹣+2H+;(3)①在25℃前,升高温度氮去除率增大的原因是因为氨气溶解度随温度升高,溶解度减小,所以答案是:升高温度NH3的溶解度降低,有利于NH3的逸出;②剩余的氧化镁,是难溶于水的物质沉淀出不形成污染,不会对废水形成二次污染,所以答案是:氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染;(4)依据滴定实验和反应化学方程式可知:
2NH3~(NH4)2B4O7~ | H2SO4 |
2 | 1 |
2×cV×10﹣3mol | cV×10﹣3mol |
水样中氮的含量= ![]() =2.8cV(g/L)=2800cV(mg/L),
=2.8cV(g/L)=2800cV(mg/L),
所以答案是:2800cV.
【考点精析】利用化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

【题目】人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉. Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(gL﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
Ⅱ.处理方案:
(1)步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2. 此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是 .
(2)步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤. ①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式: .
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式: .
③此步骤中必须控制好NaClO溶液的用量,其原因可能是 .
(3)步骤3:回收镍 以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是: .
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.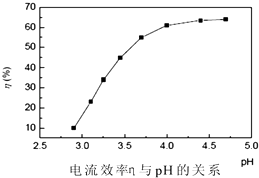
【题目】根据要求填空:
(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为;A、B、C三种元素的原子半径由大到小的顺序是 .
电离能/kJmol﹣1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
(3)已知过氧化氢分子的空间结构如图所示, 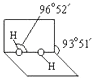 分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化: R3+ ![]() R(OH)3
R(OH)3 ![]() [R(OH)4]﹣
[R(OH)4]﹣
①基态R原子的价电子排布式为 .
②[R(OH)4]﹣中存在的化学键是 .
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为 .