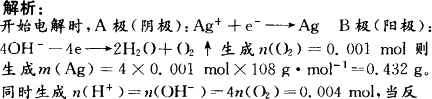题目内容
如图所示,以A、B两根石墨为电极,电解AgNO3溶液,通电t min后,在B极收集到22.4 mL(标准状况)气体;然后将电源反接,以相同的电流强度通电t/2 min,两极质量变化过程分别为:A极________,B极________.若溶液体积为200 mL(设体积不变),则溶液的pH为________.
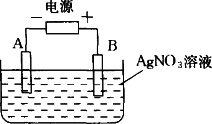
解析:
|
答案:A极:先增重0.432g,后减轻0.216 g;B极:增重0.216 g;pH=1.7 |
提示:
|
分析清楚是惰性电极电解还是活性电极电解,是一般电解还是电镀. |

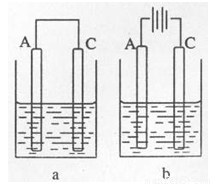
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)H2(g)+CO2(g)
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)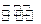 H2(g)+CO2(g)
H2(g)+CO2(g) 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 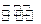 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中。 | 试管A中产生气泡量减少;试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(2)实验①的目的是________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______(填“A”或“B”或“C”)。

(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)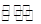 H2(g)+CO2(g)
H2(g)+CO2(g)
 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 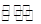 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定