题目内容
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
根据下图回答:
根据下图回答:
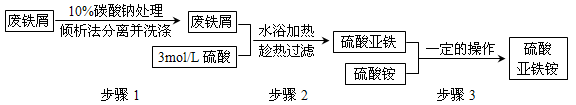
(1) 为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:_____________。
(2) 步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有___________:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3) 步骤2中铁屑过量的目的是(用离子方程式表示):__________ 。步骤2中溶液趁热过滤的原因是__________。
(4) 步骤3中,加入(NH4)2SO4固体后,应加热到溶液表面出现晶膜时,停止加热。需经过的实验操作包括:__________、__________、减压过滤(或抽滤)等得到较为干燥的晶体。
(5) 制得的硫酸亚铁铵中常含有杂质离子Fe3+,检验方法是:_____________。
(2) 步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有___________:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3) 步骤2中铁屑过量的目的是(用离子方程式表示):__________ 。步骤2中溶液趁热过滤的原因是__________。
(4) 步骤3中,加入(NH4)2SO4固体后,应加热到溶液表面出现晶膜时,停止加热。需经过的实验操作包括:__________、__________、减压过滤(或抽滤)等得到较为干燥的晶体。
(5) 制得的硫酸亚铁铵中常含有杂质离子Fe3+,检验方法是:_____________。
(1)CO32-+H2O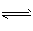 HCO3- + OH-
HCO3- + OH-
(2) A、B
(3)Fe + 2Fe3+ = 3Fe2+ ;防止溶液冷却时,硫酸亚铁因析出而损失 。
(4)蒸发浓缩;冷却结晶
(5)取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+。
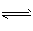 HCO3- + OH-
HCO3- + OH- (2) A、B
(3)Fe + 2Fe3+ = 3Fe2+ ;防止溶液冷却时,硫酸亚铁因析出而损失 。
(4)蒸发浓缩;冷却结晶
(5)取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液变血红色,则含Fe3+。

练习册系列答案
相关题目

 HCO3-+OH-
HCO3-+OH-
 4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。 (NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
(NH4)2SO4?FeSO4?6H2O↓)根据下图回答:


 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)