题目内容
 现有aA、bB、cC、dD、eE、gG六种短周期元素,a+b=c,a+c=d,a+d=e,d+e=g,B、C、E、G的单质均有多种同素异形体,请回答下列问题:
现有aA、bB、cC、dD、eE、gG六种短周期元素,a+b=c,a+c=d,a+d=e,d+e=g,B、C、E、G的单质均有多种同素异形体,请回答下列问题:Ⅰ.(1)C、D、E元素的第一电离能由大到小的关系为
(2)请比较C2A4、D2A4、G2A4三种化合物的沸点由高到低的顺序为
(3)有某种分子式为C4D4E8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为
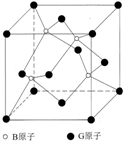
Ⅱ.BG是一种耐磨材料,其与金刚石结构相似,如图为其结构中的最小重复单元,它可由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成.
(1)指出B的三溴化物中B的杂化方式为
(2)写出合成BG的化学反应方程式为
(3)已知晶体中B与G原子的最近距离为a pm,则该晶体的密度的表达式为
分析:Ⅰ.短周期元素为1-18号元素,B、C、E、G的单质均有多种同素异形体,所以它们为硼、碳、氧、硅、硫、磷中的一种,aA、bB、cC、dD、eE、gG六种短周期元素,它们的原子序数有如下关系a+b=c,a+c=d,a+d=e,d+e=g,因各关系式中都有a,且与其它元素和小于18,所以若a=1,则b=5,所以A为氢元素,B为硼元素,符合题意;所以A为1号氢元素,B为5号硼元素,a+c=d,C的单质均有多种同素异形体可能为碳,若为碳,则d为氮元素,E为8号氧元素,符合题意;d+e=g,G为15号磷元素
所以六种短周期元素分别为A为1号氢元素,B为5号硼元素,C为6号碳元素,D为7号氮元素,E为8号氧元素,G为15号磷元素,
(1)C为6号碳元素,D为7号氮元素,E为8号氧元素,同周期自左而右元素的第一电离能呈增大趋势,ⅡA族和第IIIA族反常,故第一电离能N>O>C;
(2)C2A4、D2A4、G2A4三种化合物分别为C2H4、N2H4、P2H4,分子间有氢键沸点高,没有氢键的分子量越大沸点越高;
(3)分子式为C4D4E8的物质为C4N4O8,该物质中同种原子的化学环境完全相同,说明具有对称性,是一种威力极强的炸药,说明含有硝基,所以含4个硝基,据此分析解答;
Ⅱ.(1)根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式;
(2)根据BG是由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成解答;
(3)根据密度公式ρ=
计算,该晶体中分子个数4.
所以六种短周期元素分别为A为1号氢元素,B为5号硼元素,C为6号碳元素,D为7号氮元素,E为8号氧元素,G为15号磷元素,
(1)C为6号碳元素,D为7号氮元素,E为8号氧元素,同周期自左而右元素的第一电离能呈增大趋势,ⅡA族和第IIIA族反常,故第一电离能N>O>C;
(2)C2A4、D2A4、G2A4三种化合物分别为C2H4、N2H4、P2H4,分子间有氢键沸点高,没有氢键的分子量越大沸点越高;
(3)分子式为C4D4E8的物质为C4N4O8,该物质中同种原子的化学环境完全相同,说明具有对称性,是一种威力极强的炸药,说明含有硝基,所以含4个硝基,据此分析解答;
Ⅱ.(1)根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式;
(2)根据BG是由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成解答;
(3)根据密度公式ρ=
| m |
| v |
解答:解:Ⅰ.(1)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,C为6号碳元素,D为7号氮元素,E为8号氧元素,所以C、D、E元素的第一电离能由大到小的关系为N>O>C,
故答案为:N>O>C;
(2)C2A4、D2A4、G2A4三种化合物分别为C2H4、N2H4、P2H4,N2H4分子间有氢键沸点高,P2H4分子量大于C2H4,所以三者沸点由高到低的顺序为:N2H4>P2H4>C2H4,
故答案为:N2H4>P2H4>C2H4;
(3)分子式为C4D4E8的物质为C4N4O8,该物质中同种原子的化学环境完全相同,说明具有对称性,是一种威力极强的炸药,说明含有硝基,所以含4个硝基,四个碳建构正四面体的四个顶点,所以其结构简式为C4(NO2,)4,
故答案为: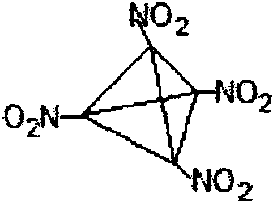 ;
;
Ⅱ.(1)B的三溴化物为BBr3,该分子中,B原子含有3个σ键不含孤电子对,所以采取sp2杂化,G的三溴化物为PBr3,PBr3中心原子P原子价层电子对为3+1=4,VSEPR模型为四面体,由于含有1对孤电子对,故为三角锥形,
故答案为:sP2;三角锥;
(2)BG是由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成,所以反应物为BBr3、PBr3、H2,产物为BP、HBr,化学方程式为:BBr3+PBr3+3H2
BP+6HBr,
故答案为:BBr3+PBr3+3H2
BP+6HBr;
(3)每个顶点上的BG分子被8个晶胞共用,每个面心上的BG分子被两个晶胞共用,所以该晶胞中BG分子个数8×
+6×
=4,一个立方磷化硼晶胞中含有4个G原子和4个B原子,B与G原子的最近距离为apm,所以
a=4r,V=NA×(
)3,则密度为:ρ=
=
,
故答案为:
.
故答案为:N>O>C;
(2)C2A4、D2A4、G2A4三种化合物分别为C2H4、N2H4、P2H4,N2H4分子间有氢键沸点高,P2H4分子量大于C2H4,所以三者沸点由高到低的顺序为:N2H4>P2H4>C2H4,
故答案为:N2H4>P2H4>C2H4;
(3)分子式为C4D4E8的物质为C4N4O8,该物质中同种原子的化学环境完全相同,说明具有对称性,是一种威力极强的炸药,说明含有硝基,所以含4个硝基,四个碳建构正四面体的四个顶点,所以其结构简式为C4(NO2,)4,
故答案为:
 ;
;Ⅱ.(1)B的三溴化物为BBr3,该分子中,B原子含有3个σ键不含孤电子对,所以采取sp2杂化,G的三溴化物为PBr3,PBr3中心原子P原子价层电子对为3+1=4,VSEPR模型为四面体,由于含有1对孤电子对,故为三角锥形,
故答案为:sP2;三角锥;
(2)BG是由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成,所以反应物为BBr3、PBr3、H2,产物为BP、HBr,化学方程式为:BBr3+PBr3+3H2
| ||
故答案为:BBr3+PBr3+3H2
| ||
(3)每个顶点上的BG分子被8个晶胞共用,每个面心上的BG分子被两个晶胞共用,所以该晶胞中BG分子个数8×
| 1 |
| 8 |
| 1 |
| 6 |
| 3 |
| 4 | ||
|
| m |
| v |
| 4×42 | ||||
NA×(
|
故答案为:
| 4×42 | ||||
NA×(
|
点评:本题考查了第一电离能大小比较、沸点高低大小比较、分子空间构型、晶胞密度的计算等知识,注意晶胞密度的计算利用均摊法、注意理解价层电子对理论与杂化轨道理论判断分子构型,题目难度较大.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目


