题目内容
(2009?广州二模)二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
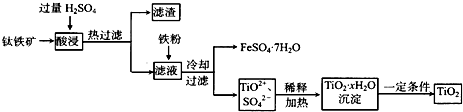
回答下列问题:
(1)Ti原子核外电子层数为4,位于元素周期表第ⅣB族.Ti原子序数为
(2)FeTiO3溶于过量硫酸的离子方程式
(3)流程中生成TiO2?xH2O离子方程式为
(4)若铁粉的用量不足,可能导致产品TiO2中混有
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C
TiCl4+

回答下列问题:
(1)Ti原子核外电子层数为4,位于元素周期表第ⅣB族.Ti原子序数为
22
22
.(2)FeTiO3溶于过量硫酸的离子方程式
FeTiO3+4H+=Fe2++TiO2++2H2O
FeTiO3+4H+=Fe2++TiO2++2H2O
.(3)流程中生成TiO2?xH2O离子方程式为
TiO2++(x+1)H2O=TiO2?xH2O+2H+
TiO2++(x+1)H2O=TiO2?xH2O+2H+
.(4)若铁粉的用量不足,可能导致产品TiO2中混有
Fe2O3
Fe2O3
杂质.(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C
| ||
2CO
2CO
,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO
CO
.分析:(1)电子层等于周期数,所以Ti元素位于第四周期,Ti位于元素周期表第ⅣB族第4列.
(2)由工艺流程转化关系可知,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O.
(3)由工艺流程转化关系可知,TiO2+在加热条件下与水反应生成TiO2?xH2O,根据电荷守恒可知还生成H+.
(4)Fe2+容易氧化为Fe3+,铁粉的用量不足,滤液中的Fe3+,不能除尽.生成的TiO2?xH2O沉淀中含有氢氧化铁.
(5)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,根据电子转移守恒计算碳元素在产物中化合价,据此结合元素守恒判断.
(2)由工艺流程转化关系可知,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O.
(3)由工艺流程转化关系可知,TiO2+在加热条件下与水反应生成TiO2?xH2O,根据电荷守恒可知还生成H+.
(4)Fe2+容易氧化为Fe3+,铁粉的用量不足,滤液中的Fe3+,不能除尽.生成的TiO2?xH2O沉淀中含有氢氧化铁.
(5)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,根据电子转移守恒计算碳元素在产物中化合价,据此结合元素守恒判断.
解答:解:(1)Ti原子核外电子层数为4,位于元素周期表第ⅣB族,所以Ti元素处于第四周期第4列,原子序数为22.
故答案为:22.
(2)由工艺流程转化关系可知,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O,反应离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O.
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O.
(3)由工艺流程转化关系可知,TiO2+在加热条件下与水反应生成TiO2?xH2O,根据电荷守恒可知还生成H+,所以反应离子方程式为TiO2++(x+1)H2O=TiO2?xH2O+2H+.
故答案为:TiO2++(x+1)H2O=TiO2?xH2O+2H+.
(4)铁粉的用量不足,滤液中的Fe3+,不能除尽.生成的TiO2?xH2O沉淀中含有氢氧化铁,最后氢氧化铁分解生成氧化铁,所以可能导致产品TiO2中混有Fe2O3.
故答案为:Fe2O3.
(5)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,令碳元素在产物中等化合价为a,则a=2×[0-(-1)],故a=2,反应中氧化剂与还原剂的物质的量之比为1:1,结合元素守恒可知,TiO2、Cl2、C、TiCl4的系数分别为1、2、2、1,所以未知物中含有C原子与O原子,碳元素化合价为+2,故为CO,系数为2.
故答案为:2CO;CO.
故答案为:22.
(2)由工艺流程转化关系可知,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O,反应离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O.
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O.
(3)由工艺流程转化关系可知,TiO2+在加热条件下与水反应生成TiO2?xH2O,根据电荷守恒可知还生成H+,所以反应离子方程式为TiO2++(x+1)H2O=TiO2?xH2O+2H+.
故答案为:TiO2++(x+1)H2O=TiO2?xH2O+2H+.
(4)铁粉的用量不足,滤液中的Fe3+,不能除尽.生成的TiO2?xH2O沉淀中含有氢氧化铁,最后氢氧化铁分解生成氧化铁,所以可能导致产品TiO2中混有Fe2O3.
故答案为:Fe2O3.
(5)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,令碳元素在产物中等化合价为a,则a=2×[0-(-1)],故a=2,反应中氧化剂与还原剂的物质的量之比为1:1,结合元素守恒可知,TiO2、Cl2、C、TiCl4的系数分别为1、2、2、1,所以未知物中含有C原子与O原子,碳元素化合价为+2,故为CO,系数为2.
故答案为:2CO;CO.
点评:考查学生对工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.

练习册系列答案
相关题目