题目内容
(11分)以下是25℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加人足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3,所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调升溶液pH=4可选择的试剂是氢氧化铜
D.Cu2+不能大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
(1)![]() (2分)
(2分)
(2)氨水;(2分) 不会引入新的杂质(2分)
(3)![]() (2分)
(2分)
(4)A C E(3分)

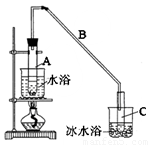
(11分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: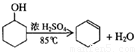
|
|
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
环已醇 |
0.96 |
25 |
161 |
能溶于水 |
|
环已烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后用 (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从 (填入编号)口进入。蒸馏时要加入生石灰的目的 。
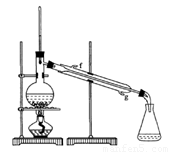
③收集产品时,控制的温度应在 左右,实验制得的环
己烯精品质量低于理论产量,可能的原因是 。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点