题目内容
某化学探究性实验小组的同学对铜与硝酸反应的实验进行了下列几方面的研究。(1)用铜屑与稀硝酸反应的实验反应速率较慢,为加快反应的速率,可采取的措施是_______________________________________。
(2)铜与稀硝酸反应的离子方程式:_____________________________;
在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是_____________________________;
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐即可达目的。那么加入碳酸盐的作用是_____________________________。
(3)在做铜与浓硝酸反应的实验时,实验小组为了减少污染,设计了以下四种装置,希望既能观察到反应现象,又能在不拆卸、不增加仪器的情况下使NO2被吸收(注:NaOH溶液可吸收NOx)以避免污染环境。他们设计的装置能达到目的的是___________。(填序号)

(4)实验小组利用上图中的___________装置(填序号),可以在不拆卸、不增加仪器的情况下,用同一装置先后连续完成铜与浓、稀硝酸的反应。要达到此目的,棉球a蘸的物质是___________,液体b为___________。
(1)微热(或加热),用铜粉替代铜屑(答任意一点即可)
(2)3Cu+2![]() +8H+
+8H+![]() 3Cu2++2NO↑+4H2O 试管内有空气存在,将生成的NO氧化为NO2(或2NO+O2
3Cu2++2NO↑+4H2O 试管内有空气存在,将生成的NO氧化为NO2(或2NO+O2![]() 2NO2) 碳酸盐与硝酸反应速率快,生成的CO2排走了试管内的空气
2NO2) 碳酸盐与硝酸反应速率快,生成的CO2排走了试管内的空气
(3)①③ (4)③ NaOH溶液 蒸馏水
解析:(1)影响化学反应速率的内因是反应物本身的性质,外因是反应的温度、接触面积等。由于反应物已经确定,要加快反应速率,只能通过升高温度或增大接触面积的方法加以实现。
(2)起初制一氧化氮时,由于装置内有一定量的空气,空气中有氧气,所以起初生成的一氧化氮总要与氧气反应而使气体呈浅红棕色。要使气体不带有颜色,就要想法去除氧气,常见的为加入少量碳酸盐用产生的气体排除,因为酸与盐的反应比氧化还原反应更容易进行。
(3)四套装置都能完成铜与浓硝酸的反应,并能观察实验现象,但②和④中反应生成的气体无法去除,所以正确答案为①③。
(4)铜与浓、稀硝酸的反应中铜是相同的,但酸中一个为浓硝酸,一个为稀硝酸,要求“不拆卸、不增加仪器”,浓硝酸变为稀硝酸时,只能通过加水来完成,所以只有③可以完成此操作,因为用注射器抽气就可使实验试管内水的倒流。氮的氧化物的吸收,通常用NaOH溶液。

| A、溶液的导电性与溶液中离子的浓度有关 | B、溶液的导电性与溶液中离子的种类有关 | C、溶液的导电性与溶液中离子的种类和数目有关 | D、往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
某化学探究性学习小组在探究溶液导电性的实验中发现:往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,而向盐酸溶液中加入少量氢氧化钠固体灯泡的明亮程度没明显变化,他们由此得到了如下一些结论,其中合理的是 ( )
| A.溶液的导电性与溶液中离子的浓度有关 |
| B.溶液的导电性与溶液中离子的种类有关 |
| C.溶液的导电性与溶液中离子的种类和数目有关 |
| D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
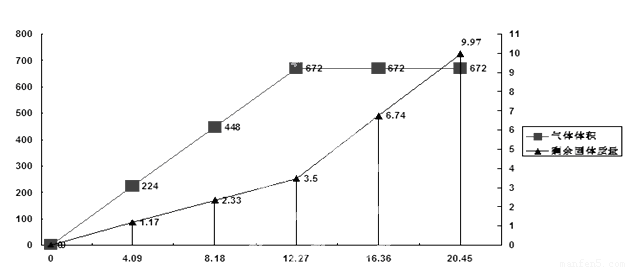
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:????????????????????????
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立;
若____________________,假设二成立;
若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)