题目内容
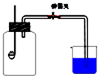
某班同学用如图所示的装置测定空气里氧气的含量.药匙上放少量钠,烧杯中装满水,先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
(1)写出燃烧匙中发生反应的化学方程式:______,将该生成物伸入瓶底的水中,生成的氧化产物与还原产物物质的量之比为:______.
(2)实验完毕,广口瓶内水面上升明显小于空气体积的1/5,对这一现象解释正确的是:______
a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内
b.该同学可能使用钠的量不足
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出.
(1)写出燃烧匙中发生反应的化学方程式:______,将该生成物伸入瓶底的水中,生成的氧化产物与还原产物物质的量之比为:______.
(2)实验完毕,广口瓶内水面上升明显小于空气体积的1/5,对这一现象解释正确的是:______
a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内
b.该同学可能使用钠的量不足
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出.

(1)在加热条件下,钠和氧气反应生成过氧化钠,反应方程式为:2Na+O2
Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,该反应中氧化产物是氧气,还原产物是氢氧化钠,该反应中有一半氢氧化钠既不是氧化产物也不是还原产物,所以氧化产物和还原产物的物质的量之比为1:2,
故答案为:2Na+O2
Na2O2;1:2;
(2)a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内,从而使广口瓶内液体上升小于五分之一,故正确;
b.该同学可能使用钠的量不足,导致氧气未完全反应,从而使广口瓶内液体上升小于五分之一,故正确;
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出,压强减小,应该使广口瓶内液体上升大于五分之一,故错误;
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出,压强减小,应该使广口瓶内液体上升大于五分之一,故错误;
故选ab.
| ||
故答案为:2Na+O2
| ||
(2)a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内,从而使广口瓶内液体上升小于五分之一,故正确;
b.该同学可能使用钠的量不足,导致氧气未完全反应,从而使广口瓶内液体上升小于五分之一,故正确;
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出,压强减小,应该使广口瓶内液体上升大于五分之一,故错误;
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出,压强减小,应该使广口瓶内液体上升大于五分之一,故错误;
故选ab.

练习册系列答案
相关题目