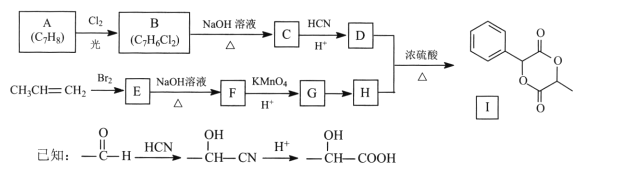
题目内容
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。工业上,通过如下转化可制得KClO3晶体:![]()
(1) 与氯元素同族的短周期元素的原子核外电子排布式为______________________。
(2)上述转化过程中所涉及的短周期元素中,原子半径由大到小的顺序是______________。
(3)硫与氯同周期,写出一个能比较硫和氯非金属性强弱的化学反应方程式____________。硫单质不溶于水,易溶于CS2,则CS2分子的结构式为___________。
(4)电解氯化钠溶液可以得到NaClO3与H2。写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________________。
(5) II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体。该反应能够发生的原因是__________________________________________________________________。
【答案】1s22s22p5 Na>Cl>O (Na>Cl>O >H亦可) H2S+Cl2→S+2HCl S=C=S ![]() 室温下,氯酸钾在水中的溶解度明显小于其他晶体
室温下,氯酸钾在水中的溶解度明显小于其他晶体
【解析】
(1)与氯元素同族的短周期元素为F,原子序数为9,核外电子数为9;
(2)上述转化过程中所涉及的短周期元素有O、Cl、Na,电子层越多,原子半径越大,同周期从左向右原子半径减小;
(3)利用单质之间的置换反应比较非金属性;CS2分子与CO2分子结构相似;
(4)电解氯化钠溶液可以得到NaClO3与H2,由电子、原子守恒可知反应为NaCl+3H2O![]() NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-;
NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-;
(5)发生复分解反应,析出KClO3晶体,与其溶解度小有关。
(1)与氯元素同族的短周期元素为F,原子序数为9,核外电子数为9,则核外电子排布式为1s22s22p5;
(2)上述转化过程中所涉及的短周期元素有O、Cl、Na,电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径由大到小的顺序是Na>Cl>O;
(3)利用单质之间的置换反应比较非金属性,能比较硫和氯非金属性强弱的化学反应方程式如H2S+Cl2=S+2HCl;CS2分子与CO2分子结构相似,CS2分子的结构式为S=C=S;
(4)电解氯化钠溶液可以得到NaClO3与H2,由电子、原子守恒可知反应为NaCl+3H2O![]() NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-,反应及电子转移的方向和数目为
NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-,反应及电子转移的方向和数目为![]() ;
;
(5)II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体.该反应能够发生的原因是室温下,氯酸钾在水中的溶解度明显小于其他晶体。