题目内容
下列有关电化学知识的描述正确的是( )
A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
D
【解析】A项,CaO+H2O=Ca(OH)2不是氧化还原反应,不能设计成原电池;B项,会发生反应:KCl+AgNO3=AgCl↓+KNO3,生成的AgCl会使盐桥的导电性减弱,所以不能使用KCl溶液,可换成KNO3溶液,B项错误;C项,由于铁遇到浓硝酸会发生钝化而生成致密氧化膜,故该组合不能构成原电池。所以C项错误;D项正确。

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
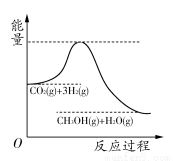
(1)上述反应平衡常数K的表达式为________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是________(填写序号字母)。
a.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
b.容器内压强保持不变
c.H2的消耗速率与CH3OH的消耗速率之比为3∶1
d.容器内的密度保持不变
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效的催化剂
某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
(1) | H2 |
|
|
|
|
(2) | CO |
|
|
| |
(3) | CH4 |
|
|
|