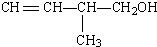题目内容
在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应:CO(g)+H2O(g)?CO2+H2(g)△H<0
已知CO的浓度变化如图所示.
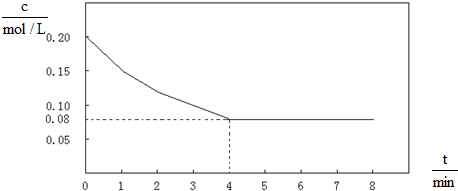
(1)从0~4min,该反应的平均速率v(CO)= mol/(L?min).该反应的平衡常数为 .
(2)为了增大CO的转化率,可以采取的措施有 .
a.增大反应物中CO的浓度 b.降低反应温度 c.将密闭容器体积压缩至
d.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 .
已知CO的浓度变化如图所示.

(1)从0~4min,该反应的平均速率v(CO)=
(2)为了增大CO的转化率,可以采取的措施有
a.增大反应物中CO的浓度 b.降低反应温度 c.将密闭容器体积压缩至
| 1 |
| 2 |
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图中有关数据,利用三段式进行计算;
(2)增大CO的转化率,平衡正向移动,根据平衡移动影响因素作判断;
(3)利用三段式进行计算;
(2)增大CO的转化率,平衡正向移动,根据平衡移动影响因素作判断;
(3)利用三段式进行计算;
解答:
解:(1)根据图中有关数据,利用三段式进行计算
CO(g)+H2O(g) CO2+H2(g)
CO2+H2(g)
开始(mol/L):0.2 0.2 0 0
变化(mol/L):0.12 0.12 0.12 0.12
平衡(mol/L):0.08 0.08 0.12 0.12
故v(CO)=
=0.03mol/(L?min)
该反应的平衡常数为
=
=2.25
故答案为:0.03,2.25;
(2)增大CO的转化率,平衡正向移动,根据平衡移动影响因素作判断;
a.增大反应物中CO的浓度,CO的转化率减小,故a错误,b.降低反应温度,因为该反应为放热反应,所以平衡正向移动,CO的转化率增大,故b正确,c.将密闭容器体积压缩至
,因为该反应前后气体体积不变,所以平衡不移动,CO的转化率不变,故c错误,d.加入适宜的催化剂,平衡不移动,CO的转化率不变,所以d错误,故答案选b;
(3)利用三段式进行计算,设水蒸气的起始浓度为x
CO(g)+H2O(g) CO2+H2(g)
CO2+H2(g)
开始(mol/L):0.2 x 0 0
变化(mol/L):0.2×90% 0.18 0.18 0.18
平衡(mol/L):0.02 x-0.18 0.18 0.18
根据平衡常数表达式有:
=2.25,则有x=0.90 mol/L,故答案为:0.90 mol/L;
CO(g)+H2O(g)
 CO2+H2(g)
CO2+H2(g)开始(mol/L):0.2 0.2 0 0
变化(mol/L):0.12 0.12 0.12 0.12
平衡(mol/L):0.08 0.08 0.12 0.12
故v(CO)=
| 0.12mol/L |
| 4min |
该反应的平衡常数为
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.12 × 0.12 |
| 0.08 ×0.08 |
故答案为:0.03,2.25;
(2)增大CO的转化率,平衡正向移动,根据平衡移动影响因素作判断;
a.增大反应物中CO的浓度,CO的转化率减小,故a错误,b.降低反应温度,因为该反应为放热反应,所以平衡正向移动,CO的转化率增大,故b正确,c.将密闭容器体积压缩至
| 1 |
| 2 |
(3)利用三段式进行计算,设水蒸气的起始浓度为x
CO(g)+H2O(g)
 CO2+H2(g)
CO2+H2(g)开始(mol/L):0.2 x 0 0
变化(mol/L):0.2×90% 0.18 0.18 0.18
平衡(mol/L):0.02 x-0.18 0.18 0.18
根据平衡常数表达式有:
| 0.18×0.18 |
| 0.02×(x-0.18) |
点评:本题主要考查了化学平衡常数的计算和运用以及影响平衡移动的因素,难度中等,在解题时要注意对平衡常数的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某元素原子最外电子层上有2个电子,下列关于该元素叙述正确的是( )
| A、是金属元素 |
| B、是ⅡA族元素 |
| C、其最高价为+2价 |
| D、不能准确判断 |
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | ||
| B、根据滴定曲线,可得Ka(HY)≈10-5 | ||
| C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
D、HY与HZ混合,达到平衡时:c(H+)═
|
 可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )
可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )| A、温度降低,化学平衡向正反应方向移动 |
| B、使用催化剂,D的物质的量分数增加 |
| C、化学方程式系数m+n=r+q |
| D、物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 |



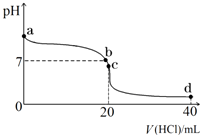 室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.