题目内容
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
D
解析试题分析:A、可以使用氧化还原的原理来制取,如HClO光照分解生成HCl,错误B、铝与浓硝酸、浓硫酸发生钝化,错误;C、氨中存在氢键,其沸点高于PH3,错误;D、正确。
考点:化学反应基本原理

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
下列解释事实的方程式不准确的是
| A.铝热法炼铁:Fe2O3 + 2Al高温 Al2O3 + 2Fe |
B.工业上用NH3制备NO:4NH3 + 5O2 4NO + 6H2O 4NO + 6H2O |
| C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32- + 2H+="=" H2O + CO2↑ |
| D.过氧化钠用于呼吸面具中作为氧气的2Na2O2 + 2CO2 ==2Na2CO3 + O2 |
下列实验和结论均正确的是
| 选项 | 操作 | 解释或结论 |
| A | 向某溶液中加入NaOH溶液,出现白色沉淀 | 溶液中一定含有Mg2+ |
| B | 在饱和的SO2溶液中通入NO2气体,溶液的pH变小 | SO2具有还原性 |
| C | 某酸HX稀释100倍后,pH增加2 | HX是强酸 |
| D | 配制FeSO4溶液时,应加入过量铁粉和稀硫酸 | 溶液中不断产生FeSO4 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
 物质 物质组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.Fe2O3与Fe3O4互为同素异形体 |
| D.常温下三者加入浓硫酸中均无明显现象 |
有6.85g铅的氧化物,用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00g固体沉淀物,这种铅的氧化物的化学式为
| A.PbO | B.PbO2 |
| C.Pb3O4 | D. Pb3O4和PbO2的混合物 |
下列各组稀溶液( )
①NaHSO4和Na2CO3 ②AICl3和NaOH
③NH4HSO4和Ba(OH)2 ④H3PO4和Ca(OH)2
只用试管、滴管及闻气味就能鉴别有几组:
| A.1组 | B.2组 | C.3组 | D.4组 |
向盛有一定量氢氧化钠溶液的烧杯中通入标准状况下448mL氮气和二氧化碳的混合气体后得到溶液A,在溶液A中逐滴加入0.1mol/L的稀盐酸至过量,并将溶液加热,产生的二氧化碳气体的物质的量与加入稀盐酸的体积的关系如图所示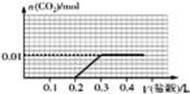
(忽略二氧化碳的溶解和氯化氢的挥发).下列说法正确的是
| A.原混合气体中氮气与二氧化碳体积之比为1:4 |
| B.在逐滴加入稀盐酸产生二氧化碳之前,发生的离子反应为CO32-+H+═HCO3- |
| C.溶液A中含有0.01molNaOH和0.01molNa2CO3 |
| D.当加入0.1L稀盐酸时,此时溶液中离子浓度大小关系为 |
下列有关物质的性质与应用不踿 相对应的是
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 |