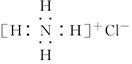题目内容
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断正确的是
| A.c(Cu2+) = c(Fe 2+) |
| B.c(Fe 2+)+ c(Cu2+)+ c(Fe 3+)= c(Clˉ) |
| C.c(Cu2+)+c(Fe 3+) =" 1.4" mol / L |
| D.c(Fe 3+) + c(Fe 2+) =" 6" mol / L |
C
解析试题分析:据方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),则A项错误;根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Clˉ),则B项错误;废液放入铜片充分反应,铜片质量减少了0.256g,其物质的量为 ,令10mL废液中Fe3+为nmol,则:
,令10mL废液中Fe3+为nmol,则:
2FeCl3+Cu═2FeCl2+CuCl2
2 1
nmol 0.004mol 解得n=0.008mol,则原废液中c(Fe 3+)= ;
;
在废液加入足量的AgNO3溶液,生成沉淀 8.61g,沉淀为AgCl,故n(AgCl)=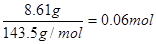 ;则原废液中c(Clˉ)=
;则原废液中c(Clˉ)= ;因原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒有3×0.8+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.2mol/L,c(Cu2+)=0.6mol/L;则有c(Cu2+)+c(Fe 3+) =" 1.4" mol / L,C项正确;c(Fe 3+) + c(Fe 2+) =" 2" mol / L,D项错误。
;因原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒有3×0.8+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.2mol/L,c(Cu2+)=0.6mol/L;则有c(Cu2+)+c(Fe 3+) =" 1.4" mol / L,C项正确;c(Fe 3+) + c(Fe 2+) =" 2" mol / L,D项错误。
考点:考查化学常用计量。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案下列化学用语或模型正确的是 ( )
A.CH3Cl | B.乙烯的结构简式 CH2CH2 |
C.硝基苯的结构简式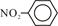 | D.CH4分子的比例模型 |
在常温下四个容积相同的抽空的密闭容器内,分别注入下列各组气体(先注入一种,再注入另一种),全部气体注入完毕后,容器中的压强从大到小的顺序是
①2mol氢气和1mol氧气 ②2mol硫化氢和1mol二氧化硫
③2mol一氧化氮和1mol氧气 ④2mol氨和lmol氯化氢
| A.①=②=③>④ | B.①>②=③>④ | C.③>④>①>② | D.①>③>④>② |
取100mL Fe(NO3)3与Cu(NO3)2的混合液,若这两种溶液物质的量浓度相等。在混合液中加入2.5mol/L NaOH溶液150mL恰好反应,则原溶液中NO3-的浓度为
| A.1.25mol/L | B.3.75mol/L | C.2.5mol/L | D.5.0mol/L |
下列有关化学用语正确的是
| A.Fe的价层电子排布式为3d64s2 | B.35Br的电子排布式可简写为[Ar]4s24p5 |
C.NH4Cl的电子式为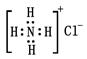 | D.氯离子结构示意图为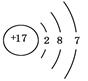 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1mol C10H22含共价键数目32NA |
| B.常温常压下,8gCH4含有电子数目5NA |
| C.1L 0.1mol?L-1的醋酸溶液中含有CH3COO-的数目0.1NA |
| D.78g苯含有C=C双键的数目为3NA |
设nA为阿伏伽德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有2nA个电子 |
| B.1L0.1mol·L-1的氨水中有nA个NH4+ |
| C.标准状况下,22.4L盐酸含有nA个HCl分子 |
| D.1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子 |
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
| A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B.1 mol Na2O2固体中含离子总数为4NA |
| C.标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |