题目内容
臭氧能与KI溶液反应,生成一种可使带火星的木条复燃的气体。向反应后的溶液中滴入酚酞,溶液变红色;若滴入淀粉溶液,则变为蓝色。为测定大气中臭氧的含量,将0℃101kPa下33.6m3的空气通入KI溶液,使之完全反应。在所得溶液中用0.01mol·L-1的Na2S2O3溶液60mL恰好与之反应完全(反应式为2Na2S2O3+I2  Na2S4O6+2NaI)。
Na2S4O6+2NaI)。
(1)完成下列化学方程式:
O3+KI+H2O——
(2)计算大气中臭氧的体积分数。
 Na2S4O6+2NaI)。
Na2S4O6+2NaI)。(1)完成下列化学方程式:
O3+KI+H2O——
(2)计算大气中臭氧的体积分数。
(1)O3+2KI+H2O  2KOH+I2+O2
2KOH+I2+O2
(2)2×10-5%
 2KOH+I2+O2
2KOH+I2+O2(2)2×10-5%
(1)由题给条件,可知O3与KI溶液反应,生成物中有O2(可使带火星的木条复燃),I2(使淀粉溶液显蓝色)和KOH溶液(溶液中滴入酚酞显红色)。
O3+KI+H2O——O2+I2+KOH
反应中元素化合价的变化情况:
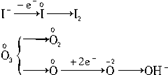
一个臭氧分子在反应中两个氧原子变为一个氧分子,可视为化合价无变化(均为单质,化合价为0);另一个氧原子则由0价变为-2价,组成OH-。根据电子数转移守恒的原则可以确定O3和KI的化学计量数分别为1和2,由此可以确定其他物质的化学计量数,写出完整的化学反应方程式:
O3+2KI+H2O O2+I2+2KOH
O2+I2+2KOH
(2)根据上述两个反应方程式可推出下列相当关系:
O3~I2~2Na2S2O3
1mol 2mol
n(O3) 0.01mol·L-1×0.06L=6×10-4mol
n(O3)=3×10-4mol
大气中O3的体积分数为
φ(O3)=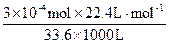 ×100%=2×10-7×100%=2×10-5%。
×100%=2×10-7×100%=2×10-5%。
O3+KI+H2O——O2+I2+KOH
反应中元素化合价的变化情况:

一个臭氧分子在反应中两个氧原子变为一个氧分子,可视为化合价无变化(均为单质,化合价为0);另一个氧原子则由0价变为-2价,组成OH-。根据电子数转移守恒的原则可以确定O3和KI的化学计量数分别为1和2,由此可以确定其他物质的化学计量数,写出完整的化学反应方程式:
O3+2KI+H2O
 O2+I2+2KOH
O2+I2+2KOH(2)根据上述两个反应方程式可推出下列相当关系:
O3~I2~2Na2S2O3
1mol 2mol
n(O3) 0.01mol·L-1×0.06L=6×10-4mol
n(O3)=3×10-4mol
大气中O3的体积分数为
φ(O3)=
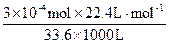 ×100%=2×10-7×100%=2×10-5%。
×100%=2×10-7×100%=2×10-5%。
练习册系列答案
相关题目
 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。