题目内容
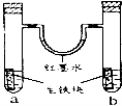
【题目】将250C 101KPa条件下的氯化氢(HCl)气体49.0L,通入492mL水中,(已知水的密度为:1.00g/mL),得到密度为1.13g/mL的盐酸(即氯化氢的水溶液)。注:250C 101KPa条件下气体摩尔体积为24.5L/mol。(计算结果保留一位小数)
(1)求此盐酸的物质的量浓度?
(2)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
【答案】
(1)4.0mol/L;(2)80.0mL;
【解析】
试题分析:(1)25℃101KPa条件下的氯化氢(HCl)气体49.6L的物质的量是![]() =2.02mol,通入492mL水中,水的质量是492g,此盐酸的质量分数=
=2.02mol,通入492mL水中,水的质量是492g,此盐酸的质量分数=![]() ×100%≈13.0%,此盐酸的物质的量浓度c=
×100%≈13.0%,此盐酸的物质的量浓度c=![]() =
=![]() mol/L≈4.0mol/L,答:此盐酸的物质的量浓度是4.0mol/L;
mol/L≈4.0mol/L,答:此盐酸的物质的量浓度是4.0mol/L;
(2)设稀释后溶液的体积是V毫升,则4.0mol/L×20.0 mL=VmL×1.00 mol/L,解得V=80.0mL,答:稀释后溶液的体积是80.0毫升.

练习册系列答案
相关题目
【题目】在四种不同条件下测得反应2SO2+O2![]() 2SO3的反应速率如下表所示:
2SO3的反应速率如下表所示:
编号 | (1) | (2) | (3) | (4) |
反应速率[mol/(L·min)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
0.4 | 0.25 | 0.5 | 0.3 |
其中反应速率最快的是( )
A.(1) B.(2) C.(3) D.(4)