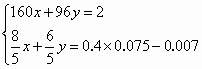题目内容
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
6![]() +5CuS+28H+
+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应.
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]()
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol.
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g.
(4)混合物中Cu2S的质量分数为________.
答案:
解析:
解析:
|
答案:(1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40% 解析:根据配平后的离子方程式,KMnO4-5(NH4)2Fe(SO4)2,则剩余KMnO4的物质的量为: 需称量固体的质量为:0.5 L×0.1 mol·L-1×392 g·mol-1=19.6 g. 假设混合物中Cu2S的物质的量为x,CuS的物质的量为y,结合以上数据列出方程组: 解得 则混合物中Cu2S的质量分数为: |

练习册系列答案
相关题目