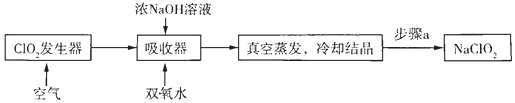
题目内容
【题目】甲、乙、丙三位同学分别用下图所示的三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
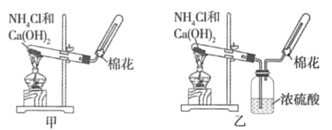
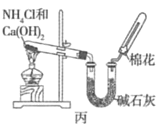
(1)三位同学制取氨气的化学方程式为__________。
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是__________(填序号)。
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大 D.氨气密度比空气小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(他们的实验操作都正确),你认为没有收集到氨气的同学是__________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是__________________________。
(4)检验氨气是否收集满的方法是__________(填序号)。
A.闻到有氨气逸出 B.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
C.棉花被气体冲出 D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的同学是__________(填“甲”、“乙”或“丙”)。
【答案】2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O BD 乙 氨气被浓硫酸吸收 B 丙
CaCl2+ 2NH3↑+ 2H2O BD 乙 氨气被浓硫酸吸收 B 丙
【解析】
(1)氯化铵与氢氧化钙共热反应生成氯化钙氨气和水;
(2)氨气极易溶于水,氨气密度比空气小;
(3)氨气与硫酸反应生成硫酸铵;
(4)实验室检验氨气是否收集满的方法是将湿的红色石蕊试纸放在管口,观察试纸颜色变化;
(5)碳酸氢铵固体受热分解生成氨气、二氧化碳和水,浓硫酸吸收氨气,碱石灰吸收二氧化碳和水。
(1)三位同学都是利用氯化铵与氢氧化钙共热反应生成氯化钙氨气和水制备氨气,其化学方程式为2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O,故答案为:2NH4Cl + Ca(OH)2
CaCl2+ 2NH3↑+ 2H2O,故答案为:2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O;
CaCl2+ 2NH3↑+ 2H2O;
(2)氨气极易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空气法收集,则三位同学都用向下排空气法收集氨气,故选BD;
(3)氨气与硫酸反应生成硫酸铵,则乙没有收集到氨气,因为氨气通过浓硫酸会被吸收,故答案为:乙;氨气被浓硫酸吸收;
(4)实验室检验氨气是否收集满的方法是将湿的红色石蕊试纸放在管口,若变蓝则已满,B正确,故答案为:B;
(5)碳酸氢铵固体受热分解生成氨气、二氧化碳和水,甲装置分解得到的是混合气体,得不到纯净氨气;乙装置分解得到混合气体通过浓硫酸后,氨气被吸收得不到氨气;丙装置分解得到混合气体通过碱石灰,二氧化碳和水蒸气被吸收,得到干燥气体氨气,故答案为:丙。

 阅读快车系列答案
阅读快车系列答案【题目】化学与生活密切相关。下列说法正确的是
A.检查酒驾时,CrO3被酒精氧化成Cr2 (SO4)3
B.向海水中加入明矾可以使海水淡化
C.碳海绵吸收泄露的原油时发生了化学变化
D.氧化钙可用作食品干燥剂
【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )

选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率