题目内容
如图是化学实验室中常用制备、干燥气体的部分仪器装置.某学校同学利用中学常用试剂及仪器设计下列实验.
(1)甲同学利用如图I装置制备并收集干燥的NO2气体,请完成下列问题: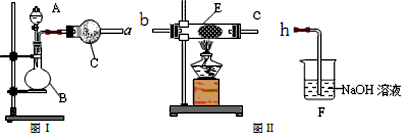
①图I中仪器B的名称:______;②收集NO2的方法______;
③B中发生反应的离子方程式为______.
④将收集满NO2的集气瓶浸入冰水中,烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因______.
(2)乙同学利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质.A中加入浓氨水,B中加入过氧化钠固体,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器 a→b→c→h.请完成下列问题:
①实验中观察到E内有红棕色气体出现,证明氨气具有______性;
②E中发生反应的化学方程式为______.
解:(1)①该仪器是圆底烧瓶.
故答案为:圆底烧瓶.
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集.
故答案为:瓶口向上排空气法收集.
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
④该反应是放热反应,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低,气体的颜色变浅.
故答案为:变浅;2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低.
(2)①氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性.
故答案为:还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2 4NO+6H2O,2NO+O2=2NO2.
4NO+6H2O,2NO+O2=2NO2.
故答案为:4NH3+5O2 4NO+6H2O;2NO+O2=2NO2.
4NO+6H2O;2NO+O2=2NO2.
分析:(1)①该仪器是圆底烧瓶.
②根据气体的溶解性、密度选取合适的收集方法.
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水.
④降低温度,平衡向放热方向移动,根据二氧化氮气体浓度变化判断气体颜色变化.
(2)①反应前后元素的化合价升高的物质是还原剂,还原剂具有还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮.
点评:本题考查了氮及其化合物的性质,难度不大,会根据气体的溶解性、密度选取合适的收集方法.
故答案为:圆底烧瓶.
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集.
故答案为:瓶口向上排空气法收集.
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
④该反应是放热反应,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低,气体的颜色变浅.
故答案为:变浅;2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低.
(2)①氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性.
故答案为:还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2
 4NO+6H2O,2NO+O2=2NO2.
4NO+6H2O,2NO+O2=2NO2.故答案为:4NH3+5O2
 4NO+6H2O;2NO+O2=2NO2.
4NO+6H2O;2NO+O2=2NO2.分析:(1)①该仪器是圆底烧瓶.
②根据气体的溶解性、密度选取合适的收集方法.
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水.
④降低温度,平衡向放热方向移动,根据二氧化氮气体浓度变化判断气体颜色变化.
(2)①反应前后元素的化合价升高的物质是还原剂,还原剂具有还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮.
点评:本题考查了氮及其化合物的性质,难度不大,会根据气体的溶解性、密度选取合适的收集方法.

练习册系列答案
相关题目
 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为: 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为: